
【题目】(1)研究SO2的性质对改善空气质量具有重要意义。某化学兴趣小组为探究SO2的化学性质进行以下实验,如下图装置(加热及固定装置已略去)。

①以上实验中,体现SO2具有氧化性的实验现象为____________,对应化学方程式为_____________________。
② D装置的作用是__________,写出该装置中发生的离子方程式______________。
③ A中反应开始后,试管B中始终无明显现象。现将试管B中溶液分成两份,分别滴加一定量的氯水和氨水,均出现白色沉淀,任选其中一个实验,结合离子方程式进行解释:_____________________________________________。
(2)硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫。
① “钠碱法”用NaOH溶液作吸收剂,向 100 mL 0.3 mol·L-1的NaOH溶液中通入标准状况下0.448 L SO2气体,所得溶液中的溶质是_________________________________(填化学式)。
② 某硫酸厂拟用含Cr2O72的酸性废水处理烟气中SO2,反应后的铬元素以Cr3+形式存在,则反应中氧化剂和还原剂的物质的量之比是__________________。
【答案】 H2S溶液变浑浊 SO2 + 2H2S = 3S + 2H2O 吸收SO2,防止污染环境 SO2 + 2OH- = SO32- + H2O Ba2+ + SO2 + 2NH3H2O = BaSO3 + 2NH4+ + H2O 或 Ba2+ + SO2 + Cl2 + 2H2O = BaSO4 + 2Cl- + 4H+ Na2SO3和NaHSO3 1 : 3
【解析】A中发生Cu+2H2SO4(浓)![]() CuSO4+2SO2↑+2H2O,通入B中无明显现象,C中盛有H2S溶液的试管中出现浅黄色浑浊现象,说明生成了S单质,二氧化硫中硫元素的化合价从+4价变为0价,表现了氧化性,反应的化学方程式为:SO2+2H2S=3S↓+2H2O,二氧化硫是一种有毒气体,多余的二氧化硫需要用氢氧化钠溶液吸收,所以D的作用是吸收多余的二氧化硫气体。
CuSO4+2SO2↑+2H2O,通入B中无明显现象,C中盛有H2S溶液的试管中出现浅黄色浑浊现象,说明生成了S单质,二氧化硫中硫元素的化合价从+4价变为0价,表现了氧化性,反应的化学方程式为:SO2+2H2S=3S↓+2H2O,二氧化硫是一种有毒气体,多余的二氧化硫需要用氢氧化钠溶液吸收,所以D的作用是吸收多余的二氧化硫气体。
(1)①体现SO2具有氧化性的实验现象H2S溶液变浑浊,对应化学方程式为SO2 + 2H2S = 3S + 2H2O;② D装置的作用是吸收SO2,防止污染环境,该装置中发生的离子方程式SO2 + 2OH- = SO32- + H2O;③ 氨水降低溶液的酸度,提高亚硫酸根离子浓度,Ba2+ + SO2 + 2NH3H2O = BaSO3 + 2NH4+ + H2O 或用氯水将二氧化硫氧化成硫酸根离子,形成 BaSO4,Ba2+ + SO2 + Cl2 + 2H2O = BaSO4 + 2Cl- + 4H+;(2)①n(SO2)=0.448L/22.4L·mol-1=0.02mol,n(NaOH)=0.1L×0.3mol·L-1=0.03mol,二者反应的化学方程式为:SO2+NaOH=NaHSO3,SO2+2NaOH=Na2SO3+H2O,所得溶液中的溶质是 Na2SO3和NaHSO3;②重铬酸根具有强氧化性,能将二氧化硫中+4价的硫氧化为+6价,离子反应为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,反应中氧化剂Cr2O72-和还原剂SO2的物质的量之比是1 : 3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】异丙苯是一种重要的有机化工原料.异丙苯的结构简式为 ![]() .
.
(1)异丙苯中至少有个碳原子共平面.
(2)异丙苯有多种同分异构体,其中一溴代物只有两种的芳香烃是(填结构简式).
(3)由异丙苯制备对溴异丙苯的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取一定质量的纯碱溶于水中,与适量的盐酸作用,下列关于盐酸的用量和气体产量的变化是(填偏大、偏小、不变)
(1)若纯碱中混有K2CO3,盐酸用量将____________;气体产量将_______________。
(2)若纯碱中混有NaHCO3,盐酸用量将___________;气体产量将_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+ MnO2![]() MnCl2 + C12↑ + 2H2O。下列说法不正确的是
MnCl2 + C12↑ + 2H2O。下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,该反应转移电子的物质的量为2 mol
C. 每消耗1 mol MnO2,被氧化的HCl的物质的量为4 mol
D. 该反应中,HCl既表现还原性又表现酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用100mL量筒量取1.3mL盐酸
B.配制氯化钠溶液时,用托盘天平称取8.55g氯化钠固体
C.容量瓶不能用作溶解物质的容器
D.粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定某过氧化氢溶液中过氧化氢的浓度,进行如下实验:取20.00mL的该过氧化氢溶液加水稀释至250.00mL,取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为:2MnO ![]() +5H2O2+6H+═2Mn2++8H2O+5O2↑.据此作答:
+5H2O2+6H+═2Mn2++8H2O+5O2↑.据此作答:
(1)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中;滴定到达终点的现象是: .
(2)配置标准溶液时使用的KMnO4固体中如果含有少量K2SO4杂质,则对测定结果的影响是 . (填“偏大”、“偏小”或“不变”)
(3)重复滴定四次,分别耗用c mol/LKMnO4标准溶液的体积为:0.99V mL、1.03V mL、1.28VmL、0.98V mL,则原过氧化氢溶液中的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B. 强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物
C. 水难电离,纯水是弱电解质
D. 溶于水能导电的化合物中一定含有阴阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一原电池的结构示意图,下列说法中,错误的是( ) 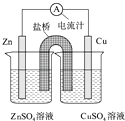
A.Cu电极为正电极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所给信息,得出的结论正确的是( ) 
A.碳的燃烧热为b kJ/mol
B.2C(s)+O2(g)═2CO(g)△H=﹣2(b﹣a) kJ/mol
C.2CO2(s)═2CO(g)+O2(g)△H=+a kJ/mol
D.C(s)+O2(g)═CO2(g)△H<﹣b kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com