
【题目】实验室制Cl2的反应为4HCl(浓)+ MnO2![]() MnCl2 + C12↑ + 2H2O。下列说法不正确的是
MnCl2 + C12↑ + 2H2O。下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,该反应转移电子的物质的量为2 mol
C. 每消耗1 mol MnO2,被氧化的HCl的物质的量为4 mol
D. 该反应中,HCl既表现还原性又表现酸性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于同温同压下的两种气体CO和N2的判断不正确的是( )
A. 体积相等时密度相等
B. 体积不相等时密度不相等
C. 体积相等时具有的电子数相等
D. 质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有0.06 mol Cl-、0.07 mol SO42 -及一定量Mg2+和Al3+的混合溶液中,滴入2 mol/L NaOH溶液,产生沉淀情况如图。若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离)。则下列说法错误的是

A.a的取值范围是0<a<1/15
B.图中m的取值范围5.2~5.8
C.A、B两点横坐标的数值均随x变化而变化
D.若B点横坐标数值为120 ,则a=0.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图装置中,U形管B中所装固体为________,C中球形干燥管的作用是_______________________。
(2)关闭K1打开K2,再打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_______________________________________。
(3)由于上述装置还存在____________缺陷,导致测定结果偏高。
【方案2】按以下步骤测定样品中AlN的纯度:

(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作中用到的主要玻璃仪器是_________。AlN的纯度是__________(用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式 .
②上述反应的平衡常数表达式K= , 根据上述信息判断,T1和T2的关系是 .
A.T1>T2 B.T1<T2 C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是 .
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2 , 具体流程如图1所示:
①用离子方程式表示反应器中发生的反应: .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 .
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的极(填“正”或“负”),b电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究SO2的性质对改善空气质量具有重要意义。某化学兴趣小组为探究SO2的化学性质进行以下实验,如下图装置(加热及固定装置已略去)。

①以上实验中,体现SO2具有氧化性的实验现象为____________,对应化学方程式为_____________________。
② D装置的作用是__________,写出该装置中发生的离子方程式______________。
③ A中反应开始后,试管B中始终无明显现象。现将试管B中溶液分成两份,分别滴加一定量的氯水和氨水,均出现白色沉淀,任选其中一个实验,结合离子方程式进行解释:_____________________________________________。
(2)硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫。
① “钠碱法”用NaOH溶液作吸收剂,向 100 mL 0.3 mol·L-1的NaOH溶液中通入标准状况下0.448 L SO2气体,所得溶液中的溶质是_________________________________(填化学式)。
② 某硫酸厂拟用含Cr2O72的酸性废水处理烟气中SO2,反应后的铬元素以Cr3+形式存在,则反应中氧化剂和还原剂的物质的量之比是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是
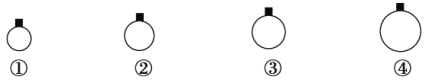
A.气球②中装的是O2
B.气球①和气球③中气体分子数相等
C.气球①和气球④中气体物质的量之比为4∶1
D.气球③和气球④中气体密度之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SOCl2是一种液态化合物,沸点为77℃.向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2 , 可观察到剧烈反应,液面上有雾形成,并带有刺激性气味气体逸出,该气体中含有可使品红溶液褪色的气体.轻轻振荡锥形瓶,待白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出.
(1)根据上述实验现象,写出SOCl2与水反应的化学方程式: .
(2)蒸干AlCl3溶液不能得到无水AlCl3 , 写出有关反应的化学方程式:;;而使SOCl2与AlCl36H2O混合加热,可以得到无水AlCl3 , 试解释原因: .
(3)已知常温下KSP[Al(OH)3]=1.3×10﹣33 , 若起始c(AlCl3)=1.0molL﹣1;则Al3+开始沉淀时的c(H+)≈molL﹣1 .
(4)Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H1=akJmol﹣1;3AlCl(g)═2Al(l)+AlCl3(g)△H2=bkJmol﹣1;
则反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=kJmol﹣1(用含a、b的代数式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com