
【题目】下列物质的分类不正确的是( )
A. SO2(氧化物) B. 碘酒(单质) C. HNO3(含氧酸) D. 氯水(混合物)
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。 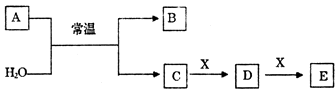
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式: .
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则:
①组成单质A的元素在周期表中的位置为 .
②X可能为(填代号).
a.NaHCO3 b.Na2CO3 c.Na2SO3 d.Al(OH)3
(3)若A为淡黄色粉末,回答下列问题:
①1molA与足量的H2O充分反应时转移的电子数目为 .
②A的电子式为。
③若X为一种造成温室效应的气体.则鉴别等浓度的D、E两种溶液,可选择的试剂为(填代号).
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红.
则A与H2O反应的化学反应方程式为 . E是(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2mol二氧化碳的叙述中,正确的是( )
A. 体积为44.8L B. 电子数为32×6.02×1023
C. 质量为88g D. 含有4mol原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+ MnO2![]() MnCl2 + C12↑ + 2H2O。下列说法不正确的是
MnCl2 + C12↑ + 2H2O。下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,该反应转移电子的物质的量为2 mol
C. 每消耗1 mol MnO2,被氧化的HCl的物质的量为4 mol
D. 该反应中,HCl既表现还原性又表现酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组为了探讨铜与硝酸的反应设计了如下实验。
(1)甲同学欲探究铜与稀硝酸反应产生的气体主要是NO,设计装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是含有一半空气的注射器。
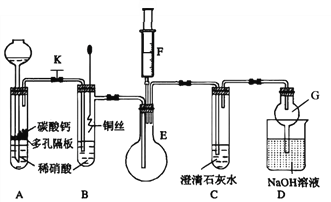
请回答有关问题:
①装置A中进行反应时打开止水夹K,当装置C中_________时,关闭止水夹K,试分析这样操作的目的是________,A中反应的离子方程式为______________。
②在完成①中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是__________________,B中反应的离子方程式为____________________。
③为进一步证明产物是NO,将注射器F中的空气推入E中,看到的现象是_________________。
④装置G的作用是_____________________。
(2)同学们发现铜与稀、浓硝酸反应所得溶液的颜色不同,并记录如下:
将1 g细铜丝放入盛有10 mL的1 mol·L-1 HNO3溶液的试管中加热 | 铜丝表面有无色气体逸出,溶液变为天蓝色 |
将1 g细铜丝放入盛有10 mL的14 mol·L-1HNO3溶液的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色 |
有同学认为是铜与浓硝酸反应的溶液中溶解了生成的气体,也有同学认为是溶液中剩余硝酸浓度较大所致,同学们分别设计了以下4个实验来判断该看法是否正确,以下方案中可行的是(选填序号字母)____________。
a. 向上述绿色溶液中通入氮气,观察颜色变化
b. 加水稀释上述绿色溶液,观察颜色变化
c. 向饱和的硝酸铜溶液中不断滴加14 mol·L-1HNO3溶液
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定某过氧化氢溶液中过氧化氢的浓度,进行如下实验:取20.00mL的该过氧化氢溶液加水稀释至250.00mL,取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为:2MnO ![]() +5H2O2+6H+═2Mn2++8H2O+5O2↑.据此作答:
+5H2O2+6H+═2Mn2++8H2O+5O2↑.据此作答:
(1)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中;滴定到达终点的现象是: .
(2)配置标准溶液时使用的KMnO4固体中如果含有少量K2SO4杂质,则对测定结果的影响是 . (填“偏大”、“偏小”或“不变”)
(3)重复滴定四次,分别耗用c mol/LKMnO4标准溶液的体积为:0.99V mL、1.03V mL、1.28VmL、0.98V mL,则原过氧化氢溶液中的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
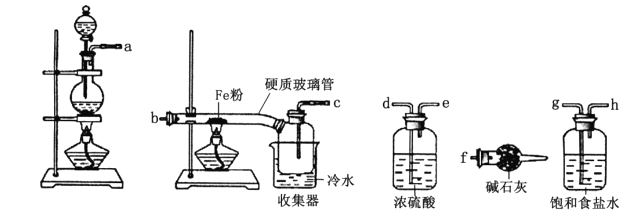
(1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。_____________
(2)硬质玻璃管中可观察到的现象是______________;硬质玻璃管与收集器之间没有用导管连接,这样做的优点是_____________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
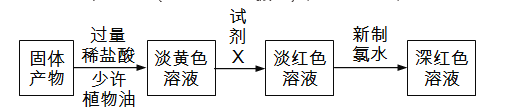
试剂X中溶质的化学式为_____________;有同学分析淡黄色溶液中含有Fe2+,你认为_____(填“合理”或“不合理”);固体产物的成分可能为_____(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱酸、弱碱的电离程度可以分别用它们的电离常数(K)或电离度(α)表示,请根据下列情景列式计算.
(1)乙酰水杨酸是一种一元弱酸(可用HA表示).在一定温度下,0.1molL﹣1的乙酰水杨酸的水溶液中,乙酰水杨酸的电离常数K(HA)为3.4×10﹣4 , 求该酸的电离度.
(2)已知在25℃时,1molL﹣1氨水中NH3H2O的电离度为0.42%,求NH3H2O的电离常数K(NH3H2O). .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com