
����Ŀ��SOCl2��һ��Һ̬������е�Ϊ77�森��ʢ��10mLˮ����ƿ�У�С�ĵμ�8��10��SOCl2 �� �ɹ۲쵽���ҷ�Ӧ��Һ���������γɣ������д̼�����ζ�����ݳ����������к��п�ʹƷ����Һ��ɫ�����壮��������ƿ����������ʧ������Һ�еμ�AgNO3��Һ���в�����HNO3�İ�ɫ����������
��1����������ʵ������д��SOCl2��ˮ��Ӧ�Ļ�ѧ����ʽ�� ��
��2������AlCl3��Һ���ܵõ���ˮAlCl3 �� д���йط�Ӧ�Ļ�ѧ����ʽ��������ʹSOCl2��AlCl36H2O��ϼ��ȣ����Եõ���ˮAlCl3 �� �Խ���ԭ�� ��
��3����֪������KSP[Al��OH��3]=1.3��10��33 �� ����ʼc��AlCl3��=1.0molL��1����Al3+��ʼ����ʱ��c��H+����molL��1 ��
��4��Al2O3��s��+AlCl3��g��+3C��s���T3AlCl��g��+3CO��g����H1=akJmol��1��3AlCl��g���T2Al��l��+AlCl3��g����H2=bkJmol��1��
��ӦAl2O3��s��+3C��s���T2Al��l��+3CO��g���ġ�H=kJmol��1���ú�a��b�Ĵ���ʽ��ʾ����
���𰸡�
��1��SOCl2+H2O=SO2��+2HCl��
��2��AlCl3+3H2O ![]() Al��OH��3��+3HCl��2Al��OH��3
Al��OH��3��+3HCl��2Al��OH��3 ![]() Al2O3+3H2O��SOCl2��ˮ��Ӧ�ȼ�����ˮ���������ɵ�HCl��������AlCl3��ˮ�⣬�����ܵõ��Ȼ�������
Al2O3+3H2O��SOCl2��ˮ��Ӧ�ȼ�����ˮ���������ɵ�HCl��������AlCl3��ˮ�⣬�����ܵõ��Ȼ�������
��3��1.0��10��3
��4��a+b
���������⣺��1��SOCl2��ˮ���ҷ�Ӧ��Һ�����а������ɣ�˵�����ɵ�������ˮ�������γ�СҺ�Σ��Ȱ�����ʧ������Һ�еμ�AgNO3��Һ���в�����HNO3�İ�ɫ����״����������˵�����ɵİ�����ϡ���ᣬ�������к���HCl�����������壬��������ʹƷ����Һ��ɫ˵�����������Ư���ԣ�����Ԫ���غ�֪���������к��ж����������Ը÷�Ӧ����ʽΪSOCl2+H2O=SO2��+2HCl�������Դ��ǣ�SOCl2+H2O=SO2��+2HCl������2���Ȼ�����ˮ����������������ϡ���ᣬ������лӷ��ԣ����ȴٽ��Ȼ���ˮ�⣬����ʱ�õ��Ĺ��������������������������������������ֽ�������������ˮ���������յõ��Ĺ���������������Ӧ�Ļ�ѧ����ʽΪ��AlCl3+3H2O ![]() Al��OH��3��+3HCl��2Al��OH��3
Al��OH��3��+3HCl��2Al��OH��3 ![]() Al2O3+3H2O��SOCl2��ˮ���ҷ�Ӧ����HCl������������ˮ�⣬��SOCl2��ˮ��Ӧ�ȼ�����ˮ�����������ܵõ��Ȼ������壬���Դ��ǣ�AlCl3+3H2O
Al2O3+3H2O��SOCl2��ˮ���ҷ�Ӧ����HCl������������ˮ�⣬��SOCl2��ˮ��Ӧ�ȼ�����ˮ�����������ܵõ��Ȼ������壬���Դ��ǣ�AlCl3+3H2O ![]() Al��OH��3��+3HCl��2Al��OH��3
Al��OH��3��+3HCl��2Al��OH��3 ![]() Al2O3+3H2O��SOCl2��ˮ��Ӧ�ȼ�����ˮ���������ɵ�HCl��������AlCl3��ˮ�⣬�����ܵõ��Ȼ������壻��3����֪������KSP[Al��OH��3]=1.3��10��33 �� ����ʼc��AlCl3��=1.0molL��1 �� C��Al3+��c3��OH����=KSP[Al��OH��3]=1.3��10��33
Al2O3+3H2O��SOCl2��ˮ��Ӧ�ȼ�����ˮ���������ɵ�HCl��������AlCl3��ˮ�⣬�����ܵõ��Ȼ������壻��3����֪������KSP[Al��OH��3]=1.3��10��33 �� ����ʼc��AlCl3��=1.0molL��1 �� C��Al3+��c3��OH����=KSP[Al��OH��3]=1.3��10��33
c��OH����= ![]() ��1.0��10��11mol/L��c��H+��=
��1.0��10��11mol/L��c��H+��= ![]() ��1.0��10��3mol/L����Al3+��ʼ����ʱ��c��H+����1.0��10��3mol/L�����Դ��ǣ�1.0��10��3����4����Al2O3��s��+AlCl3��g��+3C��s���T3AlCl��g��+3CO��g����H1=akJmol��1����3AlCl��g���T2Al��l��+AlCl3��g����H2=bkJmol��1�����ݸ�˹���ɼ����+�ڵõ������Ȼ�ѧ����ʽ��Al2O3��s��+3C��s���T2Al��l��+3CO��g����H=��a+b��KJ/mol�����Դ��ǣ�a+b��
��1.0��10��3mol/L����Al3+��ʼ����ʱ��c��H+����1.0��10��3mol/L�����Դ��ǣ�1.0��10��3����4����Al2O3��s��+AlCl3��g��+3C��s���T3AlCl��g��+3CO��g����H1=akJmol��1����3AlCl��g���T2Al��l��+AlCl3��g����H2=bkJmol��1�����ݸ�˹���ɼ����+�ڵõ������Ȼ�ѧ����ʽ��Al2O3��s��+3C��s���T2Al��l��+3CO��g����H=��a+b��KJ/mol�����Դ��ǣ�a+b��


 �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Cl2�ķ�ӦΪ4HCl��Ũ��+ MnO2![]() MnCl2 + C12�� + 2H2O������˵������ȷ����
MnCl2 + C12�� + 2H2O������˵������ȷ����
A. ��ԭ����HCl����������MnO2
B. ÿ����1 mol Cl2���÷�Ӧת�Ƶ��ӵ����ʵ���Ϊ2 mol
C. ÿ����1 mol MnO2����������HCl�����ʵ���Ϊ4 mol
D. �÷�Ӧ�У�HCl�ȱ��ֻ�ԭ���ֱ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһԭ��صĽṹʾ��ͼ������˵���У�������ǣ� �� 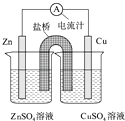
A.Cu�缫Ϊ���缫
B.ԭ��ع���ʱ�����Ӵ�Zn�缫����
C.ԭ��ع���ʱ���ܷ�ӦΪ��Zn+Cu2+=Zn2++Cu
D.���ţ���֬������KCl��Һ���е�K+����ZnSO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ��غ͵��صĵ缫���ƣ�����˵��������ǣ�������
A.ԭ�����ʧȥ���ӵ�һ��һ��Ϊ����
B.��������ֱ����Դ����������һ��һ��Ϊ����
C.�����з���������Ӧ��һ��һ��Ϊ����
D.ԭ����и���������һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������к͵ζ��������кͷ�Ӧ������֪Ũ�ȵ��ᣨ�����ⶨδ֪Ũ�ȵļ���ᣩ�����鷽����������һ��Ũ�ȵ�����������Һ�ζ�һ��Ũ�ȵ����ᣬ�����Һ��pH�仯���жϵζ��յ�����ݣ�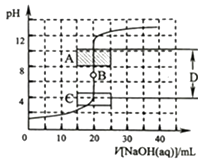
��1��Ϊ��ȷ����ͼ2���ڵζ���ʼʱ�� �� ��Һ�ٶȿ����Կ�һ�㣬���Ժͼ�¼pH�ļ���ɴ�Щ�����ӽ�ʱ����Һ�ٶ�Ӧ����һЩ������ÿ��һ�ξͲ���һ�Σ�
��2����ͼ2��A��pH��Χʹ�õ�ָʾ������C��pH��Χʹ�õ�ָʾ������B������D���ɳ�Ϊ ��
��3����������ϡ��Һ�����ΪA��0.0100molL��1������������Һ�����ΪB��0.100molL��1�����ᣮ���豾�����漰���ĸ���ϡ��Һ���ܶȾ�����Ϊ1.00gmL��1 �� ��ÿ����Һ���������Ϊ0.05mL����ʢ��20.0mLA��Һ����ƿ�еμ�1�η�̪��Һ�����õζ�������ƿ�е���10.0mLB��Һ���ߵα�����ֻ�Ϻ���Һ����ɫ����ȡ����ɫ���Һ3.00mL��һ֧�Թ��ڣ������Թ��ڵμ�1��A��Һ����ͨ������˵����ʱ�Թ�����Һ���ֵ���ɫ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᡢ����ĵ���̶ȿ��Էֱ������ǵĵ��볣����K�������ȣ�������ʾ������������龰��ʽ���㣮
��1������ˮ������һ��һԪ���ᣨ����HA��ʾ������һ���¶��£�0.1molL��1������ˮ�����ˮ��Һ�У�����ˮ����ĵ��볣��K��HA��Ϊ3.4��10��4 �� �����ĵ���ȣ�
��2����֪��25��ʱ��1molL��1��ˮ��NH3H2O�ĵ����Ϊ0.42%����NH3H2O�ĵ��볣��K��NH3H2O���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ������Ϣ���ó��Ľ�����ȷ���ǣ� �� 
A.̼��ȼ����Ϊb kJ/mol
B.2C��s��+O2��g���T2CO��g����H=��2��b��a�� kJ/mol
C.2CO2��s���T2CO��g��+O2��g����H=+a kJ/mol
D.C��s��+O2��g���TCO2��g����H����b kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��L��M����Ԫ�ص�ԭ��������������X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ�M�ǵؿ��к�����ߵĽ���Ԫ�أ�
�ش��������⣺
��1��L��Ԫ�ط���Ϊ��M��Ԫ�����ڱ��е�λ��Ϊ������Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳��������Ԫ�ط��ű�ʾ����
��2��Z��X��Ԫ�ذ�ԭ����Ŀ��l��3��2��4���ɷ���A��B��A�ĵ���ʽΪ �� B�ĽṹʽΪ ��
��3������se��������������Ԫ�أ���Lͬһ���壬Seԭ�ӱ�Lԭ�Ӷ��������Ӳ㣬��Se��ԭ������Ϊ �� ������������Ӧ��ˮ���ﻯѧʽΪ �� ����2��5����Ԫ�ص��ʷֱ���H2��Ӧ����l mol��̬�⻯��ķ�Ӧ�����£���ʾ����1mol�����ⷴӦ�ȵ���������ĸ���ţ���
a��+99.7molL��1 b��+29.7molL��1 c����20.6molL��1 d����241.8kJmol��1 ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com