
【题目】下列变化一定属于化学变化的是( )
A.升华B.蒸馏C.燃烧D.爆炸
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度和压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是
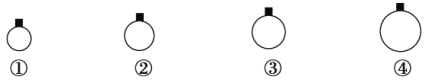
A.气球②中装的是O2
B.气球①和气球③中气体分子数相等
C.气球①和气球④中气体物质的量之比为4∶1
D.气球③和气球④中气体密度之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SOCl2是一种液态化合物,沸点为77℃.向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2 , 可观察到剧烈反应,液面上有雾形成,并带有刺激性气味气体逸出,该气体中含有可使品红溶液褪色的气体.轻轻振荡锥形瓶,待白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出.
(1)根据上述实验现象,写出SOCl2与水反应的化学方程式: .
(2)蒸干AlCl3溶液不能得到无水AlCl3 , 写出有关反应的化学方程式:;;而使SOCl2与AlCl36H2O混合加热,可以得到无水AlCl3 , 试解释原因: .
(3)已知常温下KSP[Al(OH)3]=1.3×10﹣33 , 若起始c(AlCl3)=1.0molL﹣1;则Al3+开始沉淀时的c(H+)≈molL﹣1 .
(4)Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H1=akJmol﹣1;3AlCl(g)═2Al(l)+AlCl3(g)△H2=bkJmol﹣1;
则反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=kJmol﹣1(用含a、b的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下: 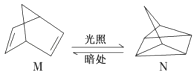
△H=+88.6kJ/mol,则M、N相比,较稳定的是 .
(2)已知CH3OH(l)的燃烧热△H=﹣238.6kJ/mol,CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2(g)△H=﹣a kJ/mol,则a238.6(填“>”“<”或“=”).
O2(g)═CO2(g)+2H2(g)△H=﹣a kJ/mol,则a238.6(填“>”“<”或“=”).
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2 , 当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式: .
(4)火箭和导弹表面的薄层是耐高温物质.将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=﹣1176kJ/mol,则反应过程中,每转移1mol电子放出的热量为 .
(5)汽车排出的尾气中含有CO和NO等气体.为了解决污染问题,在汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物CO和NO转化为无毒的大气循环物质.已知: N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)═2CO(g)△H=﹣221.0kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
请写出污染物CO和NO转化为无毒的大气循环物质的热化学方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当它们的体积比为3:2:1时,三种溶液Cl-的浓度比应是
A. 1:2:3 B. 1:1:1 C. 3:2:1 D. 3:4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e﹣═Fe+2OH﹣;
③充电时,Ni(OH)2为阳极;
④蓄电池的电极必须浸在某碱性溶液中.
A.①②③
B.②③
C.①③④
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证Cl2、Fe3+、I2三者氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
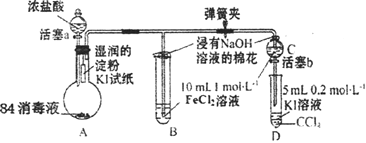
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,一段时间后,B中溶液红色加深,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,写出A中发生反应的离子方程式________。
(2)验证氯气的氧化性强于碘单质的实验现象是________。
(3)B中溶液发生反应的离子方程式是________。
(4)为验证Fe3+的氧化性强于碘单质,过程Ⅳ的操作和现象是________,对应反应的离子方程式是________。
(5)浸有氢氧化钠溶液的棉花作用是________。
(6)过程Ⅲ实验的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业;某研究性学习小组拟热分解CuCl22H2O制备CuCl,并进行相关探究。已知:该小组用如图所示装置进行实验(夹持仪器略);请回答下列问题:
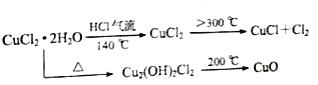
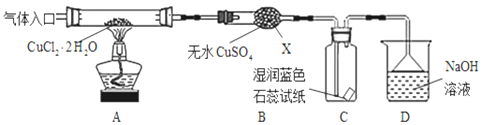
(1)仪器X的名称是_________________
(2)实验操作的先后顺序是①→______→______→______→______,_____________
①检查装置的气密性后加入药品②熄灭酒精灯,冷却 ③在“气体入口”处通干燥HCl④点燃酒精灯,加热 ⑤停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,则C中试纸的颜色变化是______
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因可能是________________________________
②若杂质是CuO,则产生的原因可能是_________________________________
(5)若m克CuCl22H2O全部转化为CuO(铜元素无损耗),则固体质量减少______克。(用含m的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
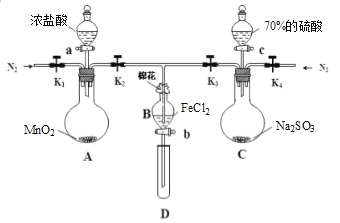
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________________________________________。
(2)棉花中浸润的溶液为________________,作用是_____________________________________________ 。
(3)A中发生反应的化学方程式________________________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是________________________________________,用________(写试剂化学式)检验氧化产物,现象是____________________________________________ 。
(5)能说明氧化性Fe3+>SO2的离子方程式是_______________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com