
【题目】某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e﹣═Fe+2OH﹣;
③充电时,Ni(OH)2为阳极;
④蓄电池的电极必须浸在某碱性溶液中.
A.①②③
B.②③
C.①③④
D.②③④
【答案】D
【解析】解:①、由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故①错误;
②、充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH﹣﹣2e﹣=Fe(OH)2 , 所以电池充电过程时阴极反应为Fe(OH)2+2e﹣=Fe+2OH﹣ , 故②正确;
③、充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣ , 阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O,Ni(OH)2做阳极,故③正确.
④、根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2 , 可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+ , 碱性电解质中最终生成Fe(OH)2 , 所以电解质溶液是碱,故④正确;
故选D.
根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2 , 可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+ , 最终生成Fe(OH)2 , Ni2O3作正极,发生还原反应,为氧化剂,得电子,最终生成Ni(OH)2 , 电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2 , 则充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣ , 阴极附近溶液的pH升高,电池充电时,阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
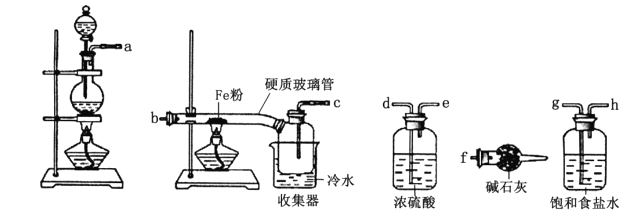
(1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。_____________
(2)硬质玻璃管中可观察到的现象是______________;硬质玻璃管与收集器之间没有用导管连接,这样做的优点是_____________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
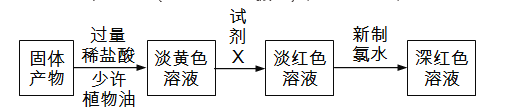
试剂X中溶质的化学式为_____________;有同学分析淡黄色溶液中含有Fe2+,你认为_____(填“合理”或“不合理”);固体产物的成分可能为_____(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱酸、弱碱的电离程度可以分别用它们的电离常数(K)或电离度(α)表示,请根据下列情景列式计算.
(1)乙酰水杨酸是一种一元弱酸(可用HA表示).在一定温度下,0.1molL﹣1的乙酰水杨酸的水溶液中,乙酰水杨酸的电离常数K(HA)为3.4×10﹣4 , 求该酸的电离度.
(2)已知在25℃时,1molL﹣1氨水中NH3H2O的电离度为0.42%,求NH3H2O的电离常数K(NH3H2O). .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:①N2(g)+O2(g)2NO(g)△H1=a kJmol﹣1
②2NO(g)+O2(g)=2NO2(g)△H2=b kJmol﹣1
③CO(g)+ ![]() O2(g)CO2(g)△H3=c kJmol﹣1
O2(g)CO2(g)△H3=c kJmol﹣1
④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4=kJmol﹣1 .
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=(用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是(填编号).
A.单位时间内生成1mol NO2的同时消耗了1mol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在恒温恒压的容器中,容器的体积保持不变
D.混合气体的平均相对分子质量保持不变
(4)反应③在(填“高温”或“低温”)下不利于自发进行.
(5)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图所示的曲线.试分析实际化工生产中不采用高压的原因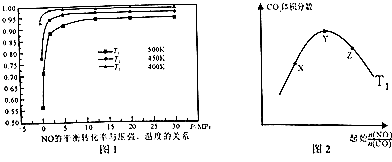
(6)探究反应④中平衡时CO2的体积分数与反应物中 ![]() 的比值、温度的关系,得到如图2所示的曲线. ①在X、Y、Z三点中,CO的转化率从大到小的顺序是 .
的比值、温度的关系,得到如图2所示的曲线. ①在X、Y、Z三点中,CO的转化率从大到小的顺序是 .
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳中下列各元素所占质量分数从大到小的顺序是( )
A.Al、Fe、Si、OB.O、Si、Al、Fe
C.Fe、Al、Si、OD.Si、O、Fe、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( ) 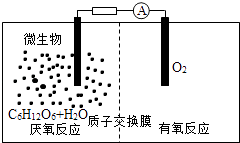
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2═6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图所示的实验操作,正确的是( )
A. 干燥Cl2 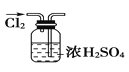
B. 配制100 mL 0.1 mol·L-1 硫酸溶液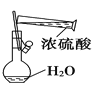
C. 分离沸点相差较大的互溶液体混合物 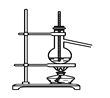
D. 分离互不相溶的两种液体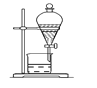
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有化合物: 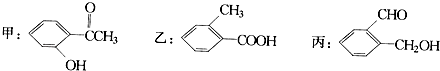
(1)请写出丙中含氧官能团的名称: .
(2)请判别上述哪些化合物互为同分异构体: .
(3)请分别写出鉴别甲、乙、丙化合物的方法.(指明所选试剂及主要现象即可)
鉴别甲的方法:;
鉴别乙的方法:;
鉴别丙的方法: .
(4)请按酸性由强至弱排列甲、乙、丙的顺序: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com