
【题目】雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:①N2(g)+O2(g)2NO(g)△H1=a kJmol﹣1
②2NO(g)+O2(g)=2NO2(g)△H2=b kJmol﹣1
③CO(g)+ ![]() O2(g)CO2(g)△H3=c kJmol﹣1
O2(g)CO2(g)△H3=c kJmol﹣1
④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4=kJmol﹣1 .
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=(用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是(填编号).
A.单位时间内生成1mol NO2的同时消耗了1mol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在恒温恒压的容器中,容器的体积保持不变
D.混合气体的平均相对分子质量保持不变
(4)反应③在(填“高温”或“低温”)下不利于自发进行.
(5)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图所示的曲线.试分析实际化工生产中不采用高压的原因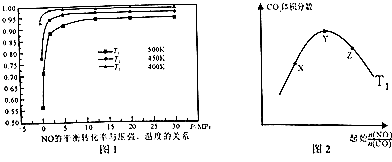
(6)探究反应④中平衡时CO2的体积分数与反应物中 ![]() 的比值、温度的关系,得到如图2所示的曲线. ①在X、Y、Z三点中,CO的转化率从大到小的顺序是 .
的比值、温度的关系,得到如图2所示的曲线. ①在X、Y、Z三点中,CO的转化率从大到小的顺序是 .
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线 .
【答案】
(1)2c﹣a
(2)![]()
(3)CD
(4)高温
(5)常压下NO的转化率已经较高,并且高压要增加成本
(6)Z>Y>X;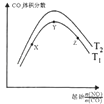
【解析】解:(1)根据盖斯定律,反应②×2﹣③即得,确定反应④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4=(2c﹣a)KJ/mol,所以答案是:2c﹣a;(2)根据反应①的方程式得出Kp= ![]() ,所以答案是:Kp=
,所以答案是:Kp= ![]() ;(3)A.单位时间内生成1mol NO2的同时消耗了1mol NO,都是正反应,故不能说明达到平衡状态,故A错误;B.依据ρ=
;(3)A.单位时间内生成1mol NO2的同时消耗了1mol NO,都是正反应,故不能说明达到平衡状态,故A错误;B.依据ρ= ![]() ,气体的总质量一定,体积一定,故密度保持不变,故混合气体的密质不再发生改变不能说明达到平衡状态,故B错误;C.2NO(g)+O2(g)=2NO2(g)为反应前后气体体积改变的反应,在恒温恒压的容器中,容器的体积保持不变,可以证明反应达到平衡状态,故C正确;D.混合气体的容器中,容器的体积保持不变,依据M=
,气体的总质量一定,体积一定,故密度保持不变,故混合气体的密质不再发生改变不能说明达到平衡状态,故B错误;C.2NO(g)+O2(g)=2NO2(g)为反应前后气体体积改变的反应,在恒温恒压的容器中,容器的体积保持不变,可以证明反应达到平衡状态,故C正确;D.混合气体的容器中,容器的体积保持不变,依据M= ![]() ,气体的总质量不变,2NO(g)+O2(g)=2NO2(g)为反应前后气体体积改变的反应,则物质的量n改变,平均摩尔质量未到达平衡前始终变化,只有达到平衡才能保持不变,所以可以证明反应达到平衡状态,故C正确;
,气体的总质量不变,2NO(g)+O2(g)=2NO2(g)为反应前后气体体积改变的反应,则物质的量n改变,平均摩尔质量未到达平衡前始终变化,只有达到平衡才能保持不变,所以可以证明反应达到平衡状态,故C正确;
故选:CD;(4)反应CO(g)+ ![]() O2(g)CO2(g)为放热的、熵减小的反应,要使△H﹣T△S<0,则高温时不利于自发进行,所以答案是:高温;(5)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,所以答案是:常压下NO的转化率已经较高,并且高压要增加成本;(6)①温度一定,随反应物NO、CO的起始物质的量比增大,X﹣Y反应正向进行,一氧化碳的转化率X<Y,Y﹣Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X,所以答案是:Z>Y>X;②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,又T2<T1 , 所以温度为T2时的变化趋势曲线为:
O2(g)CO2(g)为放热的、熵减小的反应,要使△H﹣T△S<0,则高温时不利于自发进行,所以答案是:高温;(5)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,所以答案是:常压下NO的转化率已经较高,并且高压要增加成本;(6)①温度一定,随反应物NO、CO的起始物质的量比增大,X﹣Y反应正向进行,一氧化碳的转化率X<Y,Y﹣Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X,所以答案是:Z>Y>X;②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,又T2<T1 , 所以温度为T2时的变化趋势曲线为:  ,所以答案是:
,所以答案是:  .
.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡状态的判断的理解,了解状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


科目:高中化学 来源: 题型:
【题目】量取20 mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4 mL四氯化碳,用力振荡后静置,实验现象为( )
A.液体分层,上层为四氯化碳层,黄色
B.液体分层,上层为水层,紫色
C.液体分层,下层为四氯化碳层,紫色
D.液体分层,下层为水层,黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇不仅在生产和生活中有着广泛的用途,还具有科学实验价值.
(1)乙醇是酒精饮料的主要成分,由葡萄糖发酵生成,反应的化学方程式为:C6H12O6(aq)→2C2H5OH(aq)+2CO2(g),当C6H12O6在3h内减小的浓度为0.58molL﹣1时,2C2H5OH增加的速率是molL﹣1h﹣1 .
(2)把一段弯曲成螺旋状的铜丝放在酒精灯外焰上加热,铜丝表面生成一薄层黑色的氧化铜,立即把它插入到乙醇里反应的化学方程式是 .
(3)写出与乙醇和乙酸酯化产物组成相同且属于能发生银镜反应的酯的所有同分异构体的结构简式: .
(4)请以乙醇为原料设计合成  的流程(无机试剂任用).有机合成流程示例如下:
的流程(无机试剂任用).有机合成流程示例如下: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下: 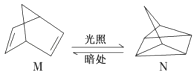
△H=+88.6kJ/mol,则M、N相比,较稳定的是 .
(2)已知CH3OH(l)的燃烧热△H=﹣238.6kJ/mol,CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2(g)△H=﹣a kJ/mol,则a238.6(填“>”“<”或“=”).
O2(g)═CO2(g)+2H2(g)△H=﹣a kJ/mol,则a238.6(填“>”“<”或“=”).
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2 , 当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式: .
(4)火箭和导弹表面的薄层是耐高温物质.将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=﹣1176kJ/mol,则反应过程中,每转移1mol电子放出的热量为 .
(5)汽车排出的尾气中含有CO和NO等气体.为了解决污染问题,在汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物CO和NO转化为无毒的大气循环物质.已知: N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)═2CO(g)△H=﹣221.0kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
请写出污染物CO和NO转化为无毒的大气循环物质的热化学方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月24日在京沪高速公路扬州境内高邮段发生了一起重大交通事故,是由于大雾引起的汽车追尾,雾属于下列哪种分散系( )
A.乳浊液B.溶液C.胶体D.悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e﹣═Fe+2OH﹣;
③充电时,Ni(OH)2为阳极;
④蓄电池的电极必须浸在某碱性溶液中.
A.①②③
B.②③
C.①③④
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A. 18 g水中所含的电子数为10NA
B. ![]() 与足量氯气充分反应时转移的电子数为
与足量氯气充分反应时转移的电子数为![]()
C. 0.3 mol·L-1 Na2SO4溶液中含0.6NA个Na+
D. 11.2 L氮气中含NA个氮原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的信息,判断下列叙述不正确的是
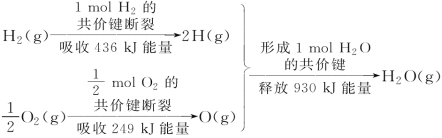
A.1 mol H2的共价键形成放出436 kJ能量
B.氢气跟氧气反应生成水的同时吸收能量
C.1 mol H2(g)跟![]() mol O2(g)反应生成1 mol H2O(g)释放能量245 kJ
mol O2(g)反应生成1 mol H2O(g)释放能量245 kJ
D.1 mol H2(g)与![]() mol O2(g)的总能量大于1 mol H2O(g)的能量
mol O2(g)的总能量大于1 mol H2O(g)的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com