
【题目】1 mol/L FeCl3溶液与1 mol/L KCl溶液中的Cl-的浓度之比( )
A.5:2B.3:1C.15:2D.1:3
科目:高中化学 来源: 题型:
【题目】某校课外活动小组为了探讨铜与硝酸的反应设计了如下实验。
(1)甲同学欲探究铜与稀硝酸反应产生的气体主要是NO,设计装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是含有一半空气的注射器。
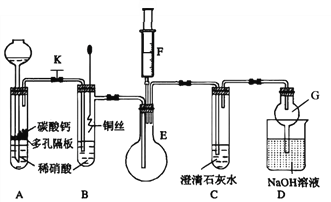
请回答有关问题:
①装置A中进行反应时打开止水夹K,当装置C中_________时,关闭止水夹K,试分析这样操作的目的是________,A中反应的离子方程式为______________。
②在完成①中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是__________________,B中反应的离子方程式为____________________。
③为进一步证明产物是NO,将注射器F中的空气推入E中,看到的现象是_________________。
④装置G的作用是_____________________。
(2)同学们发现铜与稀、浓硝酸反应所得溶液的颜色不同,并记录如下:
将1 g细铜丝放入盛有10 mL的1 mol·L-1 HNO3溶液的试管中加热 | 铜丝表面有无色气体逸出,溶液变为天蓝色 |
将1 g细铜丝放入盛有10 mL的14 mol·L-1HNO3溶液的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色 |
有同学认为是铜与浓硝酸反应的溶液中溶解了生成的气体,也有同学认为是溶液中剩余硝酸浓度较大所致,同学们分别设计了以下4个实验来判断该看法是否正确,以下方案中可行的是(选填序号字母)____________。
a. 向上述绿色溶液中通入氮气,观察颜色变化
b. 加水稀释上述绿色溶液,观察颜色变化
c. 向饱和的硝酸铜溶液中不断滴加14 mol·L-1HNO3溶液
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能,下列有关叙述正确的是( )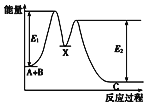
A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的△H<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱酸、弱碱的电离程度可以分别用它们的电离常数(K)或电离度(α)表示,请根据下列情景列式计算.
(1)乙酰水杨酸是一种一元弱酸(可用HA表示).在一定温度下,0.1molL﹣1的乙酰水杨酸的水溶液中,乙酰水杨酸的电离常数K(HA)为3.4×10﹣4 , 求该酸的电离度.
(2)已知在25℃时,1molL﹣1氨水中NH3H2O的电离度为0.42%,求NH3H2O的电离常数K(NH3H2O). .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素在元素周期表中位置可预测其原子结构,而物质的组成和结构亦可决定物质的性质.
(1)用元素符号表示下列微粒![]()
![]()
![]()
![]()
,,,
(2)依据原子结构与元素周期律知识,下列排序正确的是(填字母序号).
A.微粒半径:r(Al3+)<r(Mg2+)<r(Na+)<r(F)<r(O2)
B.物质酸性:H3AlO3<H4SiO4<H3PO4<H2SO4<HClO4
C.熔点高低:Li>Na>K>Rb>Cs
D.与氢气化合容易程度:F2>Cl2>Br2>I2>N2
(3)有X、Y、Z、W四种元素,已知Y和X形成的化合物YX中,X的化合价为﹣1,Y和Z形成化合物Y2Z,X、Y、Z离子的核外电子总数都是18,W的+1价离子就是质子.
①分别写出下列物质的电子式:YX;W2Z .
②写出X单质与Y的最高价氧化物对应的水化物常温下反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:①N2(g)+O2(g)2NO(g)△H1=a kJmol﹣1
②2NO(g)+O2(g)=2NO2(g)△H2=b kJmol﹣1
③CO(g)+ ![]() O2(g)CO2(g)△H3=c kJmol﹣1
O2(g)CO2(g)△H3=c kJmol﹣1
④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4=kJmol﹣1 .
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=(用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是(填编号).
A.单位时间内生成1mol NO2的同时消耗了1mol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在恒温恒压的容器中,容器的体积保持不变
D.混合气体的平均相对分子质量保持不变
(4)反应③在(填“高温”或“低温”)下不利于自发进行.
(5)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图所示的曲线.试分析实际化工生产中不采用高压的原因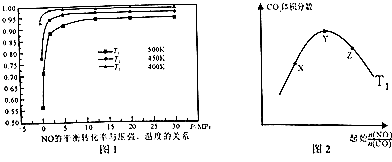
(6)探究反应④中平衡时CO2的体积分数与反应物中 ![]() 的比值、温度的关系,得到如图2所示的曲线. ①在X、Y、Z三点中,CO的转化率从大到小的顺序是 .
的比值、温度的关系,得到如图2所示的曲线. ①在X、Y、Z三点中,CO的转化率从大到小的顺序是 .
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳中下列各元素所占质量分数从大到小的顺序是( )
A.Al、Fe、Si、OB.O、Si、Al、Fe
C.Fe、Al、Si、OD.Si、O、Fe、Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com