
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下: 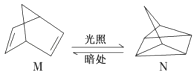
△H=+88.6kJ/mol,则M、N相比,较稳定的是 .
(2)已知CH3OH(l)的燃烧热△H=﹣238.6kJ/mol,CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2(g)△H=﹣a kJ/mol,则a238.6(填“>”“<”或“=”).
O2(g)═CO2(g)+2H2(g)△H=﹣a kJ/mol,则a238.6(填“>”“<”或“=”).
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2 , 当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式: .
(4)火箭和导弹表面的薄层是耐高温物质.将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=﹣1176kJ/mol,则反应过程中,每转移1mol电子放出的热量为 .
(5)汽车排出的尾气中含有CO和NO等气体.为了解决污染问题,在汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物CO和NO转化为无毒的大气循环物质.已知: N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)═2CO(g)△H=﹣221.0kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
请写出污染物CO和NO转化为无毒的大气循环物质的热化学方程式是: .
【答案】
(1)M
(2)<
(3)2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=﹣290.0 kJ?mol﹣1
(4)98kJ
(5)2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=﹣746.5kJ/mol
【解析】解:(1)有机物M经过太阳光光照可转化成N,:△H=+88.6kJmol﹣1,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定;
所以答案是:M;(2)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热,
所以答案是:<;(3)1molCl2参与反应时释放出145KJ热量,则反应2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)会放出290KJ的能量,即2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=﹣290.0 kJmol﹣1,
所以答案是:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=﹣290.0 kJmol﹣1;(4)4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=﹣1176kJmol﹣1,转移12mol电子放热1176KJ,则反应过程中,每转移1mol电子放热98kJ,
所以答案是:98kJ;(5)N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mo1①
2C(s)+O2(g)═2CO(g);△H=﹣221.0kJ/mo1②
C(s)+O2(g)═CO2(g);△H=﹣393.5kJ/mo1③
根据盖斯定律可得:③×2﹣①﹣②,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=﹣746.5 kJmol﹣1,
所以答案是:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=﹣746.5kJ/mol.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定某过氧化氢溶液中过氧化氢的浓度,进行如下实验:取20.00mL的该过氧化氢溶液加水稀释至250.00mL,取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为:2MnO ![]() +5H2O2+6H+═2Mn2++8H2O+5O2↑.据此作答:
+5H2O2+6H+═2Mn2++8H2O+5O2↑.据此作答:
(1)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中;滴定到达终点的现象是: .
(2)配置标准溶液时使用的KMnO4固体中如果含有少量K2SO4杂质,则对测定结果的影响是 . (填“偏大”、“偏小”或“不变”)
(3)重复滴定四次,分别耗用c mol/LKMnO4标准溶液的体积为:0.99V mL、1.03V mL、1.28VmL、0.98V mL,则原过氧化氢溶液中的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池和电解池的电极名称,下列说法错误的是( )
A.原电池中失去电子的一极一定为负极
B.电解池中与直流电源负极相连的一极一定为阴极
C.电解池中发生氧化反应的一极一定为阳极
D.原电池中负极的质量一定减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱酸、弱碱的电离程度可以分别用它们的电离常数(K)或电离度(α)表示,请根据下列情景列式计算.
(1)乙酰水杨酸是一种一元弱酸(可用HA表示).在一定温度下,0.1molL﹣1的乙酰水杨酸的水溶液中,乙酰水杨酸的电离常数K(HA)为3.4×10﹣4 , 求该酸的电离度.
(2)已知在25℃时,1molL﹣1氨水中NH3H2O的电离度为0.42%,求NH3H2O的电离常数K(NH3H2O). .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所给信息,得出的结论正确的是( ) 
A.碳的燃烧热为b kJ/mol
B.2C(s)+O2(g)═2CO(g)△H=﹣2(b﹣a) kJ/mol
C.2CO2(s)═2CO(g)+O2(g)△H=+a kJ/mol
D.C(s)+O2(g)═CO2(g)△H<﹣b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:①N2(g)+O2(g)2NO(g)△H1=a kJmol﹣1
②2NO(g)+O2(g)=2NO2(g)△H2=b kJmol﹣1
③CO(g)+ ![]() O2(g)CO2(g)△H3=c kJmol﹣1
O2(g)CO2(g)△H3=c kJmol﹣1
④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4=kJmol﹣1 .
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=(用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是(填编号).
A.单位时间内生成1mol NO2的同时消耗了1mol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在恒温恒压的容器中,容器的体积保持不变
D.混合气体的平均相对分子质量保持不变
(4)反应③在(填“高温”或“低温”)下不利于自发进行.
(5)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图所示的曲线.试分析实际化工生产中不采用高压的原因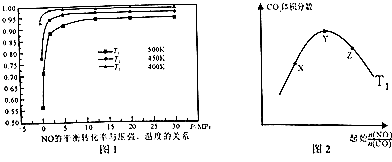
(6)探究反应④中平衡时CO2的体积分数与反应物中 ![]() 的比值、温度的关系,得到如图2所示的曲线. ①在X、Y、Z三点中,CO的转化率从大到小的顺序是 .
的比值、温度的关系,得到如图2所示的曲线. ①在X、Y、Z三点中,CO的转化率从大到小的顺序是 .
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( ) 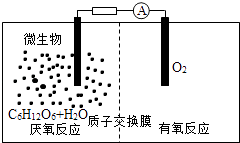
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2═6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol的Fe含_______个铁原子(用6.02×1023表示阿伏加德罗常数),质量是_____g;
(2)3mol CO2在标准状况下的体积为___________L,摩尔质量为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com