
【题目】CuCl广泛应用于化工和印染等行业;某研究性学习小组拟热分解CuCl22H2O制备CuCl,并进行相关探究。已知:该小组用如图所示装置进行实验(夹持仪器略);请回答下列问题:
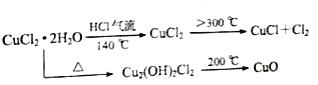
(1)仪器X的名称是_________________
(2)实验操作的先后顺序是①→______→______→______→______,_____________
①检查装置的气密性后加入药品②熄灭酒精灯,冷却 ③在“气体入口”处通干燥HCl④点燃酒精灯,加热 ⑤停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,则C中试纸的颜色变化是______
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因可能是________________________________
②若杂质是CuO,则产生的原因可能是_________________________________
(5)若m克CuCl22H2O全部转化为CuO(铜元素无损耗),则固体质量减少______克。(用含m的式子表示)
【答案】 球形干燥管 )③;④;②;⑤ 石蕊试纸先逐渐变为红色,后褪色 加热时间不足或温度偏低 通入HCl的量不足 ![]()
【解析】根据已知流程可知,热分解CuCl22H2O制备CuCl,先要在HCl气流中加热得到CuCl2固体,然后高温条件下使CuCl2分解为CuCl和Cl2。Cu2+易水解,低温加热时若不通入HCl气流,则会水解生成Cu2(OH)2Cl2,高温下分解得CuO。
(1)仪器X的名称为球形干燥管,故答案为:球形干燥管;
(2)实验中有HCl气体加入,有气体生成,所以要先检验装置的气密性。在点燃酒精灯进行反应之前,要先通入气体赶走装置中的氧气和水蒸气,因为氧气会氧化CuCl,水蒸气会引起铜的水解;在HCl气流中充分加热制备CuCl;反应结束后先熄灭酒精灯,冷却后再停止HCl气流,通入氮气将装置中的Cl2全部赶入NaOH溶液中,使其被充分吸收。所以操作顺序为:③;④;②;⑤。
故答案为:③;④;②;⑤
(3)B中有白色变为蓝色,说明有水生成,产物中还有Cl2,所以C中石蕊试纸先逐渐变为红色,后褪色。
故答案为:石蕊试纸先逐渐变为红色,后褪色;
(4)①杂质是CuCl2,说明“![]() ”进行不够彻底,即CuCl2没有反应完全。可能原因是加热时间不足或温度偏低;
”进行不够彻底,即CuCl2没有反应完全。可能原因是加热时间不足或温度偏低;
故答案为:加热时间不足或温度偏低
②杂质是CuO,说明在加热过程中部分晶体水解生成Cu2(OH)2Cl2,然后分解得到了CuO,或装置中有氧气,使CuCl被氧化。可能原因为:可能是没有在HCl的氛围中加热或者未等试管冷却就停止通入HCl气体。
故答案为:通入HCl的量不足。
(5)根据关系式: CuCl22H2O~CuO,若铜没有损耗,则二者的物质的量相等,所以固体质量的减少量=m(CuCl22H2O)-m(CuO)=m-![]() =
=![]() .
.
故答案为: ![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于原电池和电解池的电极名称,下列说法错误的是( )
A.原电池中失去电子的一极一定为负极
B.电解池中与直流电源负极相连的一极一定为阴极
C.电解池中发生氧化反应的一极一定为阳极
D.原电池中负极的质量一定减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( ) 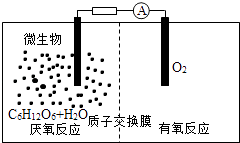
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2═6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 实验室应将钠保存在煤油中
B. 钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠
C. 将铝箔在酒精灯上加热,现象为铝箔融化但并不滴落是因为氧化铝的熔点高于铝单质
D. 金属钠失火不可用水来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图所示的实验操作,正确的是( )
A. 干燥Cl2 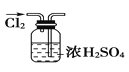
B. 配制100 mL 0.1 mol·L-1 硫酸溶液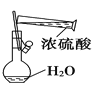
C. 分离沸点相差较大的互溶液体混合物 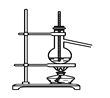
D. 分离互不相溶的两种液体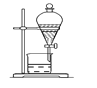
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.
回答下列问题:
(1)L的元素符号为;M在元素周期表中的位置为;五种元素的原子半径从大到小的顺序是(用元素符号表示).
(2)Z、X两元素按原子数目比l:3和2:4构成分子A和B,A的电子式为 , B的结构式为 .
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 , 其最高价氧化物对应的水化物化学式为 . 该族2~5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是(填字母代号).
a.+99.7molL﹣1 b.+29.7molL﹣1 c.﹣20.6molL﹣1 d.﹣241.8kJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol的Fe含_______个铁原子(用6.02×1023表示阿伏加德罗常数),质量是_____g;
(2)3mol CO2在标准状况下的体积为___________L,摩尔质量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100 nm(1nm=10-9m)的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质 ①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀。正确的选项有:
A.①④⑤B.②③④C.②③⑥D.①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com