
����Ŀ������к͵ζ��������кͷ�Ӧ������֪Ũ�ȵ��ᣨ�����ⶨδ֪Ũ�ȵļ���ᣩ�����鷽����������һ��Ũ�ȵ�����������Һ�ζ�һ��Ũ�ȵ����ᣬ�����Һ��pH�仯���жϵζ��յ�����ݣ�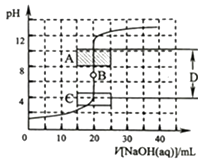
��1��Ϊ��ȷ����ͼ2���ڵζ���ʼʱ�� �� ��Һ�ٶȿ����Կ�һ�㣬���Ժͼ�¼pH�ļ���ɴ�Щ�����ӽ�ʱ����Һ�ٶ�Ӧ����һЩ������ÿ��һ�ξͲ���һ�Σ�
��2����ͼ2��A��pH��Χʹ�õ�ָʾ������C��pH��Χʹ�õ�ָʾ������B������D���ɳ�Ϊ ��
��3����������ϡ��Һ�����ΪA��0.0100molL��1������������Һ�����ΪB��0.100molL��1�����ᣮ���豾�����漰���ĸ���ϡ��Һ���ܶȾ�����Ϊ1.00gmL��1 �� ��ÿ����Һ���������Ϊ0.05mL����ʢ��20.0mLA��Һ����ƿ�еμ�1�η�̪��Һ�����õζ�������ƿ�е���10.0mLB��Һ���ߵα�����ֻ�Ϻ���Һ����ɫ����ȡ����ɫ���Һ3.00mL��һ֧�Թ��ڣ������Թ��ڵμ�1��A��Һ����ͨ������˵����ʱ�Թ�����Һ���ֵ���ɫ ��
���𰸡�
��1���ζ��յ�ζ��յ�
��2����̪�����ȣ��ζ��յ㣻pHͻ�䷶Χ
��3����ɫ
���������⣺��1������к͵ζ�ʱ���ζ���ʼ�͵ζ��յ��ĵζ��ٶȿ��Կ�һЩ���ӽ��ζ��յ��ٶ�Ҫ������ֹ�ζ����������Դ��ǣ��ζ��յ�ζ��յ㣻��2�����ȡ���̪�ı�ɫ��Χ�ֱ���pH��3.1��4.4��8.2��10֮�䣬A��pH��Χʹ�õ�ָʾ���Ƿ�̪��C��pH��Χʹ�õ�ָʾ���Ǽ��ȣ��ζ��յ�ʱ����Һ��pHΪ7��B���ǵζ��յ㣻�ӽ��ζ��յ�ʱ��pH����ͻ�䣻���Դ��ǣ���̪�����ȣ��ζ��յ㣻pHͻ�䷶Χ����3����20.0mLA��Һ��10.0mLB��Һ��Ӧ��Ļ��Һ�У�n��H+��=0.01L��0.100molL��1��0.02L��0.01molL��1=8��10��4mol����ȡ��3.00mL�����Һ�����е�n��H+����=8��10��5mol��
1��A��Һ�е�n��OH����=0.05��10��3L��0.0100molL��1=5��10��7mol��
n��H+���䣾n��OH������������Һ�����ԣ�������ɫ��
���Դ��ǣ���ɫ��
�����㾫�������ڱ��⿼�������к͵ζ�����Ҫ�˽��к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ���ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ҹ����Ƶ�����ּ���������������̼������������������ǵ��¼�����������Ҫ���أ�
��1������̿�����ڴ���������Ⱦ��NO����1L�����ܱ������м���0.100mol NO��2.030mol�������̿�������ʣ�����������E������F�����¶ȷֱ���T1���T2��ʱ�����ƽ��ʱ�����ʵ����ʵ������±���
�������ϱ����ݣ�д��NO�����̿��Ӧ�Ļ�ѧ����ʽ ��
��������Ӧ��ƽ�ⳣ������ʽK= �� ����������Ϣ�жϣ�T1��T2�Ĺ�ϵ�� ��
A��T1��T2 B��T1��T2 C�����Ƚ�
����T1���·�Ӧ�ﵽƽ������д�ʩ�ܸı�NO��ת���ʵ��� ��
a������c��NO�� b������ѹǿ c�������¶� d����ȥ����F
��2����ѭ�����ղ���������SO2���ͻ�����Ⱦ��ͬʱ�����Ƶ�H2 �� ����������ͼ1��ʾ��
�������ӷ���ʽ��ʾ��Ӧ���з����ķ�Ӧ�� ��
���û�ѧƽ���ƶ���ԭ����������HI�ֽⷴӦ��ʹ��Ĥ��Ӧ�������H2��Ŀ���� ��
��3����������Դ�ǽ��������Ⱦ����Ч;��֮һ��ֱ�Ӽ״�ȼ�ϵ�أ����DMFC�����ڽṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע��DMFC����ԭ����ͼ2��ʾ��
ͨ��a����ĵ缫��ԭ��ص������������������b�缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ������c��NH ![]() ����c��Cl����=1��1����Һ������NH4Cl��Һ�м��������ģ� ��
����c��Cl����=1��1����Һ������NH4Cl��Һ�м��������ģ� ��
A.Ũ����
B.�Ȼ��ƾ���
C.Ũ��ˮ
D.�������ƹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��CuCl���������л��ϳɹ�ҵ�еĴ������ڿ�����Ѹ�ٱ���������ɫ��������ֽ⣬��ɺ�ɫ����ͼ�ǹ�ҵ��������ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl��������CuCl�����̣� 
����������Ϣ�ش��������⣺
��1������������X�Ļ�ѧʽΪ ��
��2��д������CuCl�Ļ�ѧ����ʽ�� ��
��3����CuCl�����ɹ����������ϲ���Ҫ����SO2���壬��ϻ�ѧ����ʽ�ͱ�Ҫ������˵������ �� ʵ��������SO2Ҫ�ʵ�������ԭ�����������һ�㼴�ɣ���
��4��ʵ��̽��pH��CuCl���ʵ�Ӱ�����±���ʾ��
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl����/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
����CuCl�������pHΪ �� ��pH�ϴ�ʱCuCl���ʱ��ԭ���� �� ����pHʱ������ܡ����ܡ�������ͬpH������������ᣬ������ ��
��5���Ȼ���ͭ�Ķ��������� �ٳ�ȡ��Ʒ0.25g������FeCl3��Һ����ƿ�У�����ܽ⣮
����0.10molL��1���������Һ�ζ�����֪��CuCl+FeCl3�TCuCl2+FeCl2��Fe2++Ce4+�TFe3++Ce3+ �� ����ƽ��ʵ�������£�ƽ��ʵ�������ܳ���1%����
ƽ��ʵ����� | 1 | 2 | 3 |
0.25g��Ʒ�������������Һ�������mL�� | 24.35 | 24.05 | 23.95 |
����Ʒ��CuCl�Ĵ���Ϊ�����������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SOCl2��һ��Һ̬������е�Ϊ77�森��ʢ��10mLˮ����ƿ�У�С�ĵμ�8��10��SOCl2 �� �ɹ۲쵽���ҷ�Ӧ��Һ���������γɣ������д̼�����ζ�����ݳ����������к��п�ʹƷ����Һ��ɫ�����壮��������ƿ����������ʧ������Һ�еμ�AgNO3��Һ���в�����HNO3�İ�ɫ����������
��1����������ʵ������д��SOCl2��ˮ��Ӧ�Ļ�ѧ����ʽ�� ��
��2������AlCl3��Һ���ܵõ���ˮAlCl3 �� д���йط�Ӧ�Ļ�ѧ����ʽ��������ʹSOCl2��AlCl36H2O��ϼ��ȣ����Եõ���ˮAlCl3 �� �Խ���ԭ�� ��
��3����֪������KSP[Al��OH��3]=1.3��10��33 �� ����ʼc��AlCl3��=1.0molL��1����Al3+��ʼ����ʱ��c��H+����molL��1 ��
��4��Al2O3��s��+AlCl3��g��+3C��s���T3AlCl��g��+3CO��g����H1=akJmol��1��3AlCl��g���T2Al��l��+AlCl3��g����H2=bkJmol��1��
��ӦAl2O3��s��+3C��s���T2Al��l��+3CO��g���ġ�H=kJmol��1���ú�a��b�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ͼ�����ʵ��ת��
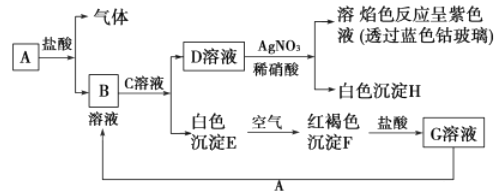
�Իش�
��1��д��B�Ļ�ѧʽ________��D�Ļ�ѧʽ________��
��2��д����Eת���F�Ļ�ѧ����ʽ________��
��3��д���������ӷ���ʽ��
D��Һ��AgNO3��Һ��Ӧ________����G��Һ�м���A________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ����ͬ��NaCl��MgCl2��AlCl3������Һ�������ǵ������Ϊ3:2:1ʱ��������ҺCl����Ũ�ȱ�Ӧ��
A. 1:2:3 B. 1:1:1 C. 3:2:1 D. 3:4:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ� ��
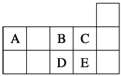
A. D�ڹ�����B��ȼ�յ���Ҫ����ΪDB3
B. C���⻯���ˮ��Һ���Ա�E��ǿ
C. D��B�γɵ������ӿ�����DB32����D2B42��
D. E�����������γ�����������Ժ�����Һ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com