
某恒温密闭容器中,可逆反应A(s)  B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
 A.产物B的状态只能为固态或液态
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗∶n(C)消耗=1∶1
C.保持体积不变,向平衡体系中加入A,平衡向正反应方向移动
D.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是
A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA
D.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下面提到的问题中,与盐的水解有关的是( )
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③实验室配制AlCl3溶液时,应先把它溶解在盐酸中,而后加水稀释
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑦在NH4Cl或AlCl3溶液中加入金属镁会生成氢气
⑧草木灰与铵态氮肥不能混合施用
⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性
A.①④⑦ B.②⑤⑧ C.③⑥⑨ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol·L-1 | 0.010 | 0.020 | 0.0 |
| c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60% B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
在t℃下,某反应达到平衡,平衡常数K= 。恒容时,温
。恒容时,温 度升高,NO浓度减小。下列说法正确的是 ( )
度升高,NO浓度减小。下列说法正确的是 ( )
A.该反应的焓变为正值 B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度
C.升高温度,逆反应速率减小 D.该反应化学方程式为:NO+SO3 NO2+SO2
NO2+SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
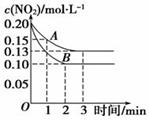
 某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2 的物质的量随时间变化如下图中实线所示(图中字母后数对表示对应的坐标):
的物质的量随时间变化如下图中实线所示(图中字母后数对表示对应的坐标):
回答下列问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是________(填序号)。
a.0~1 min b.1~3 min c.3~8 min d.8~11 min
(2)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是________________,曲线Ⅱ改变的条件可能是________________。
(3)下列表述能表示该反应已达平衡的是__ ______(填序号)。
______(填序号)。
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体的平均摩尔质量不再改变 d.容器内各物质的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的化工原料。工业上常用反应:
3Cl2+8NH3===N2+6NH4Cl 检验氯气管道是否漏气。根据材料中的反应回答下列问题:
(1)氧化剂是 ,还原剂是 。
(2)氧化剂与被氧化的还原剂分子个数比为 。
(3)当有68 g NH3参加反应时,将会有 mol电子发生转移,被氧化的物质为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中,关于用途的说法不正确的是 ( )
A.75%(体积分数)的酒精溶液常用于医疗消毒
B.乙烯主要用于作燃料使用
C. 石油裂化的主要目的是为了得到轻质油
D.乙酸常用作调味剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com