
NaHCO3和NaHSO4的溶液混合后,实际参加反应的离子是
A.H+和CO B.HCO
B.HCO 和H+
和H+
C.Na+、HCO 和H+ D.HCO
和H+ D.HCO 和HSO
和HSO
科目:高中化学 来源: 题型:
生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述正确的是
A.“加碘盐”、“高钙牛奶”、“富硒营养品”等食用品中的碘、钙、硒是指单质
B.“酸可以除锈”,“热的纯碱溶液去油污”都是发生了化学变化
C.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质
D.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是
(2)Na2S溶液中离子浓度由大到小的顺序为____________________________________,向该溶液中加入少量固体CuSO4,溶液pH________(填“增大”、“减小”或“不变”)。
(3)已知100℃时水的离子积Kw是1.0×10-12,100 ℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为___________
(4)25 ℃在等体积的①pH=0的H2SO4溶液,② 0.05 mol·L-1的Ba(OH)2溶液,③pH = 10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器中,可逆反应A(s)  B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
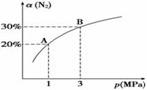 A.产物B的状态只能为固态或液态
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗∶n(C)消耗=1∶1
C.保持体积不变,向平衡体系中加入A,平衡向正反应方向移动
D.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H22NH3是工业上合成氨的重要反应。

(1)根据图1请写出合成氨的热化学方程式__________________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的________条件,该条件的改变与图2中哪一时刻条件的改变相同________(用“t1~t6”表示)。
(3)t3时刻改变的条件是____________,t5时刻改变的条件是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是
A.胶体粒子的直径在1~100 nm之间
B.氢氧化铁胶体带电
C.可用渗析的方法分离蛋白质和氯化钠的混合溶液
D.胶体能稳定存在的主要原因是胶体粒子带电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
把V L含MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.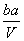 mol·L-1 B.
mol·L-1 B.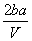 mol·L-1
mol·L-1
C.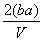 mol·L-1 D.
mol·L-1 D. mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol NH4+ 所含质子数为10NA
B.CO2的摩尔质量为44 g
C.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D.标准状况下,22.4 LHCl溶于水形成1L溶液,所得溶液中溶质的物质的量浓度为22.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列有关偏二甲肼(C2H8N2)叙述正确的是 ( )
A.偏二甲肼的摩尔质量为60g B.1 mol偏二甲肼的质量为60 g/mol
C.6.02×1023个偏二甲肼分子的质量为60 g D.6 g偏二甲肼含有NA个偏二甲肼分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com