
����Ŀ����ҵ�����ظ����ƣ�Na2Cr2O7���ᾧ���ĸҺ������������Fe3+�������ظ���أ�K2Cr2O7�����������̼���������ܽ��������ͼ��
��1����Na2Cr2O7����K2Cr2O7�Ļ�ѧ����ʽΪ �� ͨ����ȴ�ᾧ��������K2Cr2O7��ԭ���� ��
��2����Na2Cr2O7ĸҺ�мӼ�Һ��pH��Ŀ���� ��
��3������A��ҪΪ���ѧʽ��������B��ҪΪ���ѧʽ����
��4������ˮϴ�ӹ���A�����յ�ϴ��Һת�Ƶ�ĸҺ��������У�������߲����ֿ�ʹ�ܺ���ͣ�
���𰸡�
��1��Na2Cr2O7+2KCl�TK2Cr2O7+2NaCl��������K2Cr2O7���ܽ��ԶС��������֣����¶ȵĽ��ͣ�K2Cr2O7���ܽ�����Լ�С
��2����ȥFe3+
��3��NaCl��K2Cr2O7
��4����
���������⣺�����̿�֪���ܽ�����pH��ȥ��������Fe3+ �� ���˺������ᾧ�õ�Na2Cr2O7 �� Ȼ�����KCl����Na2Cr2O7+2KCl�TK2Cr2O7+2NaCl������ܽ��ͼ��֪��������K2Cr2O7���ܽ�Ƚ�С������ȴ�ᾧ�õ�K2Cr2O7 �� ĸҺII����Ũ��ֻ������NaCl��A����ĸҺ����ȴ�ᾧ��Ҫ�õ�K2Cr2O7 �� ��1����Na2Cr2O7����K2Cr2O7�Ļ�ѧ����ʽΪNa2Cr2O7+2KCl�TK2Cr2O7+2NaCl�����ܽ��ͼ��֪��������K2Cr2O7���ܽ��ԶС��������֣����¶ȵĽ��ͣ�K2Cr2O7���ܽ�����Լ�С�����ͨ����ȴ�ᾧ��������K2Cr2O7���壬���Դ��ǣ�Na2Cr2O7+2KCl�TK2Cr2O7+2NaCl��������K2Cr2O7���ܽ��ԶС��������֣����¶ȵĽ��ͣ�K2Cr2O7���ܽ�����Լ�С����2��ĸҺ�к���������Fe3+ �� ��Na2Cr2O7ĸҺ�мӼ�Һ��pH��Ŀ���dz�ȥFe3+ �� ���Դ��ǣ���ȥFe3+����3��������������֪��AΪNaCl��BΪK2Cr2O7 �� ���Դ��ǣ�NaCl��K2Cr2O7����4������ˮϴ�ӹ���A��ϴ��Һ�к�K2Cr2O7 �� Ϊ��߲����ֿ�ʹ�ܺ���ͣ�����յ�ϴ��Һת�Ƶ�ĸҺ���У�����ȴ�ᾧ�õ�K2Cr2O7 �� ���Դ��ǣ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E����Ԫ�ص�ԭ���������ε�����A��B��C��Dλ�ڶ����ڣ�A��ԭ�Ӱ뾶��С��Ԫ�أ�B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����E�С����������֮�ƣ�E4+���ԭ�ӵĺ�������Ų���ͬ��A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬A��B����Ԫ����ɵ�ԭ�Ӹ���֮��Ϊ1��1�Ļ�����N�dz������л��ܼ�����ش��������⣨����ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ����
��1��A2D2���ӵĵ���ʽΪ �� E�Ļ�̬ԭ�ӵ���Χ�����Ų�ʽΪ ��
��2��B��C��D����Ԫ�صĵ�һ��������С�����˳��Ϊ ��
��3������B��C������������ˮ�����Ũ��Һ�ȷ�Ӧ���仯ѧ����ʽΪ
��4������������ȷ����������ţ���a��M�Ǽ��Է��ӣ�N�ǷǼ��Է��� b�� M��BD2�����е�����ԭ�Ӿ�����sp2�ӻ�
c��N�����к���6���Ҽ���1���м�d��BD2������۵㡢�е㶼�ȶ������辧��ĵ�
��5����֪����E��һ��������Q���侧���ṹ��ͼ��ʾ
��Q��s��+2Cl2��g��=ECl4��l��+D2��g����H=+140kJ/mol
��2B��s��+D2��g��=2BD��g����H=��221kJ/mol
д������Q�ͽ�̿��������Ӧ����Һ̬ECI4��BD������Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Xֻ������Al����NH4��2SO4��MgCl2��FeCl2��AlCl3�е�һ�ֻ�����ɣ�ijͬѧ�Ըù������������ʵ�飬�����ж���ȷ���ǣ� �� 
A.��ɫ�����Ҳ�һ����Al��OH��3
B.�����һ���Ǵ�����
C.����X��һ�����ڣ�NH4��2SO4��MgCl2
D.����X��һ������FeCl2��AlCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2����Դ�������ǽ������ЧӦ����Ҫ;������ͼ����һ����������NH3����CO2������Ҫ������Ʒ��������ķ�Ӧ�� 
�����й����������˵����ȷ���ǣ� ��
A.����ʽΪC3H6N3O3
B.�����мȺ����Լ����ֺ��Ǽ��Լ�
C.���ڹ��ۻ�����
D.���ɸ����ʵ�������ӦΪ�кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С���о���������������ʱ���ı�ijһ�����Ի�ѧƽ���Ӱ�죬�õ����±仯���ɣ�ͼ��P��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ������� 
�������Ϲ����жϣ����н�����ȷ���ǣ� ��
A.��Ӧ��H��0��P2��P1
B.��Ӧ��H��0��T1��T2
C.��Ӧ��H��0��T2��T1���H��0��T2��T1
D.��Ӧ������H��0��T2��T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1����ͼΪ�������ӵĽṹʾ��ͼ�����������գ�
���������ӽṹ��������������ĸ��ţ���ͬ����A���ӵİ뾶B���ӵİ뾶�����������������=������
��2���л���M����̫������տ�ת����N��ת���������£� 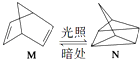 ��H=+88.6kJmol��1��M��N��ȣ����ȶ����� ��
��H=+88.6kJmol��1��M��N��ȣ����ȶ����� ��
��3����������������Ӧ����1molˮ�����ų�����241.8kJ��д���÷�Ӧ���Ȼ�ѧ����ʽΪ�� ��
��4��һ���¶�����ij���������з�����Ӧ��2A��g��+3B��g��2C��g������ʼʱ��A��Ũ��Ϊ2molL��1 �� B��Ũ��Ϊ4molL��1 �� 2min��A��Ũ�ȼ���0.8molL��1 �� ���v��B��= �� v��C��= ��
����2minĩ��C��Ũ���� �� B��Ũ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100 0 mol��L-1NaOH��Һ�ζ�20.00 mL 0.100 0mol��L-1CH3COOH��Һ���õζ���������ͼ������˵����ȷ����
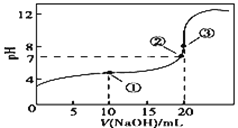
A. �����ʾ��Һ�У�c(CH3COO-)��c(OH-)=c(CH3COOH)��c(H��)
B. �����ʾ��Һ�У�c(Na��)=c(CH3COO-)=c(H��)=c(OH-)
C. �õζ����̿�ѡ�������Ϊָʾ��
D. ��Һ�Т����۵�ˮ�ĵ���̶ȣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����������������������أ�������������ȷ����( )
A.̩�����κ�������ʴ�����һ��һ·�����߹��ҵ���ɫ��Ʒ������Ҫ�ɷ־�Ϊ��������
B.��ʯī�а������ʯīϩ��Ƭ�ܵ��磬����ǵ����
C.��������Ͱ�������Һ����Һ�������������
D.������ˮ��������ֳ����������ɱ��H7N9�Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L�����г���0.5mol N2��1.5mol H2������Ӧ��N2��g��+3H2��g��![]() 2NH3��g����H ="-92.4" kJmol-1�����й��ڸ÷�Ӧ��˵����ȷ����
2NH3��g����H ="-92.4" kJmol-1�����й��ڸ÷�Ӧ��˵����ȷ����
A. ��Ӧ�ﵽƽ��ʱ���ų�46.2 kJ������
B. �����������ѹ����0.5L������ߵ�λ����ڻ���Ӱٷ������Ӷ��ӿ�����Ӧ���ʣ������淴Ӧ����
C. �κ�ʱ�̾��У�����N2��=3����H2��=2����NH3��
D. ����������������䣬����ͨ��0.5mol N2��1.5mol H2����N2��ת���ʱ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com