
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D. 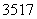 Cl与
Cl与 Cl得电子能力相同
Cl得电子能力相同
科目:高中化学 来源: 题型:
将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各叙述正确的是( )
A、正极附近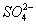 的浓度逐渐增大
的浓度逐渐增大
B、负极附近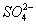 的浓度逐渐减小
的浓度逐渐减小
C、负极附近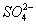 的浓度逐渐增大
的浓度逐渐增大
D、正负极附近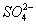 的浓度基本不变
的浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.两个原子或多个原子之间的相互作用叫做共价键
B.阴、阳离子间通过静电引力而形成的化学键叫做离子键
C.只有金属元素和非金属元素化合时才能形成离子键
D.大多数的盐、碱和低价金属氧化物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.二氯甲烷(CH2Cl2)分子的中心原子是sp3杂化,键角均为109°28′
B.CH2O和ClO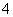 的中心原子上都含有孤对电子
的中心原子上都含有孤对电子
C.BCl3、PCl5、H2O分子中均有一种原子的最外层电子不满足8e-稳定结构
D.C2H4中含5个sp2—s σ键和1个p—p π键
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
4种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性。回答下列问题:
| M | N | ||
| X | Y |
(1)元素X在周期表中的位置是第________周期、第________族,其单质可采用电解熔融________的方法制备。
(2)M、N、Y三种元素最高价氧化物对应的水化物中,酸性最强的是________,碱性最强的是________。(填化学式)
(3)气体分子(MN)2的电子式为________。(MN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排序正确的是( )
A.酸性:H2CO3<C6H5OH<H3COOH
B.碱性:Ba(OH)2<Ca(OH)2<KOH
C.熔点:MgBr2<SiCl4<BN
D.沸点:PH3<NH3<H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中一定能大量共存的是( )
A.pH=0的溶液中:ClO-、Cu2+、SO 、K+
、K+
B.使pH试纸变红色的溶液中:Fe2+、I-、NO3-、Cl-
C.能够和金属镁反应放出气体的溶液中:Na+、H+、SO 、Cl-
、Cl-
D.常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HS-、Ca2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com