
下列各组离子在溶液中一定能大量共存的是( )
A.pH=0的溶液中:ClO-、Cu2+、SO 、K+
、K+
B.使pH试纸变红色的溶液中:Fe2+、I-、NO3-、Cl-
C.能够和金属镁反应放出气体的溶液中:Na+、H+、SO 、Cl-
、Cl-
D.常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HS-、Ca2+
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D. 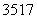 Cl与
Cl与 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下图装置可以用来制取、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )
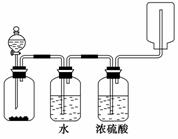
A.锌和盐酸制备氢气
B.二氧化锰与浓盐酸制备氯气
C.碳酸钙和盐酸制备二氧化碳
D.氯化钠和浓硫酸制备氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表的一部分,下列说法正确的是( )
A.可在灰色区域“甲”中寻找催化剂
B.离子半径:W-﹥X+﹥Y3-
C.气态氢化物的稳定性:Z﹥W
D.工业上电解X和W化合物的水溶液制备X

查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式正确的是 ( )
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为
N2(g)+3H2(g)  2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+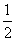 O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为
H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
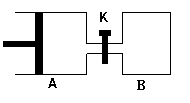
如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g),
Z(g)+2W(g),
达到平衡时V(A)=1.2aL。试回答:
⑴A中X的转化率为 。
⑵A、B中X转化率大小关系为A B(填“>”、“<”、“=” )
⑶打开K,一段时间后又达到新的平衡时,A的体积为 L(连通管中气体体积不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用如图所示装置进行化学反应X+2Y===2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到试管中甲处下降,乙处上升。下列关于该反应的叙述正确的是
①该反应为放热反应;②生成物的总能量比反应物的总能量高;③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来。
A.①②③ B.①③
C.①② D.③

查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛与亚硫酸氢钠的反应方程式为HCHO+NaHSO3 HO-CH2-SO3Na,反应产物俗称“吊白块”。关于“吊白块”的叙述正确的是( )
HO-CH2-SO3Na,反应产物俗称“吊白块”。关于“吊白块”的叙述正确的是( )
A.易溶于水,可用于食品加工
B.易溶于水,工业上用作防腐剂
C.难溶于水,不能用于食品加工
D.难溶于水,可以用作防腐剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com