
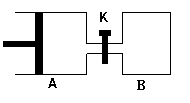
如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g),
Z(g)+2W(g),
达到平衡时V(A)=1.2aL。试回答:
⑴A中X的转化率为 。
⑵A、B中X转化率大小关系为A B(填“>”、“<”、“=” )
⑶打开K,一段时间后又达到新的平衡时,A的体积为 L(连通管中气体体积不计)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁铵
[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3 mol·L-1 H2SO4溶液,在60 ℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有________(填仪器编号);
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵
⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是________________________________________________;
(3)在步骤3中,“一系列操作”依次为____________、__________和过滤;
(4) 本实验制的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的试剂是____________,可以观察到的现象是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是( )
A.若甲为焦炭,则丁可能是O2 B.若甲为Fe,则丁可能是Cl2
C.若甲为AlCl3,则丁可能是NH3 D.若甲为NaHCO3,则丁可能是HCl

查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中一定能大量共存的是( )
A.pH=0的溶液中:ClO-、Cu2+、SO 、K+
、K+
B.使pH试纸变红色的溶液中:Fe2+、I-、NO3-、Cl-
C.能够和金属镁反应放出气体的溶液中:Na+、H+、SO 、Cl-
、Cl-
D.常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HS-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
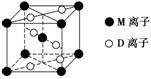
A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体。
(1)M的基态原子价层电子排布式为___________________________________________,元素B、D、G的第一电离能由大到小的顺序是________________________(用元素符号表示)。
(2)用价层电子对互斥理论预测,GD 的立体构型是____________(用文字表述)。
的立体构型是____________(用文字表述)。
(3)M与D形成的一种橙红色晶体晶胞结构如下图所示,其化学式为________(用元素符号表示)。
(4)已知化合物EB结构与单晶硅相似,该物质可由E的氯化物与NaB3在高温下反应制得,且生成单质B2,该反应化学方程式为_______________________________________________,若有8.4 g B2生成,则转移电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)硅主要以硅酸盐、____________等化合物的形式存在于地壳中。
(2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________相结合,其晶胞中共有8个原子,其中在面心位置贡献________个原子。
(3)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为______________________________________。
(4)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是________________________________________________________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是________________________________
________________________________________________________________________。
(5)在硅酸盐中,SiO 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为__________,Si与O的原子数之比为__________,化学式为__________。
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为__________,Si与O的原子数之比为__________,化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知吡啶(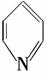 )与苯环性质相似。有机
)与苯环性质相似。有机 物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分。下列说法不正确的是( )
物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分。下列说法不正确的是( )
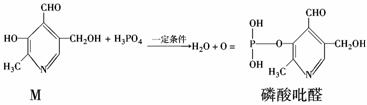
A.M能使酸性高锰酸钾溶液褪色
B.1 mol M 能与金属钠反应,消耗2 mol Na
能与金属钠反应,消耗2 mol Na
C.1 mol磷酸吡醛与NaOH溶液反应,最多消耗3 mol NaOH
D.M与足量H2反应后所得有机物的分子式为C8H17O3N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com