
分析 (1)浓硫酸增重3.6g为水的质量,根据n=$\frac{m}{M}$计算水的物质的量,根据H原子守恒计算n(H);
碱石灰增重4.4g为二氧化碳的质量,根据n=$\frac{m}{M}$计算二氧化碳,根据n=$\frac{V}{Vm}$计算氧气的物质的量,根据m=nM计算氧气的质量,根据质量守恒计算CO的质量,根据n=$\frac{m}{M}$计算CO的物质的量,再根据C原子守恒计算n(C);
(2)根据氧原子守恒3gA中氧原子的质量,再根据(1)(2)中的计算确定该物质的最简式及分子式;
(3)有机物含C、H、O元素,为醇或醚.
解答 解:(1)浓硫酸增重3.6g为水的质量,n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,根据H原子守恒可知n(H)=2n(H2O)=0.4mol,
碱石灰增重4.4g为二氧化碳的质量,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,
4.48L氧气的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,氧气的质量=0.2mol×32g/mol=6.4g
故CO的质量=3g+6.4g-3.6g-4.4g=1.4g,故 n(CO)=$\frac{1.4g}{28g/mol}$=0.05mol,
根据C原子守恒可知n(C)=n(CO2)+n(CO)=0.1mol+0.05mol=0.15mol,
答:3gA中所含氢原子、碳原子的物质的量各是0.4mol、0.15mol;
(2)由O原子守恒可知3gA中n(O)=2n(CO2)+n(CO)+n(H2O)-2n(O2)=2×0.1 mol+0.05 mol+0.2 mol-2×0.2 mol=0.05mol,
由(1)(2)可知3gA中3g A中,n(H)=0.4mol,n(C)=0.15mol,
所以,n(C):n(H):n(O)=3:8:1,故A的最简式为C3H8O,由H原子与碳原子数目可知,H原子已经饱和C原子四价结构,故其最简式即为分子式,A的分子式为C3H8O,
答:该有机物的分子式为C3H8O;
(3)有机物的分子式为C3H8O,为醇或醚,可能结构简式为CH3CH2CH2OH、CH3CHOHCH3、CH3OCH2CH3,
答:有机物A可能的结构简式为CH3CH2CH2OH、CH3CHOHCH3、CH3OCH2CH3.
点评 本题考查有机物分子式计算的确定,为高频考点,把握燃烧规律、原子守恒、质量守恒为解答的关键,侧重分析与应用能力的考查,注意守恒法的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )| A. | 1个晶胞中离子的总数为18 | |
| B. | X2+离子的配位数为8,Y2-离子的配位数为4 | |
| C. | 与每个X2+距离最近的X2+共有12个 | |
| D. | 该化合物的化学式为CaS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2F2+2H2O═4HF+O2 | B. | AgNO3+NaCl═AgCl↓+NaNO3 | ||
| C. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | MgCl2(熔融)$\frac{\underline{\;高温\;}}{\;}$Mg+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.72L CO | B. | 6.6gCO2 | C. | 8gSO3 | D. | 9.8gH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (b)(c)(d) | B. | (a)(d) | C. | (b)(c)(d)(e)(f) | D. | (b)(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 二氧化硅不与强酸反应,用玻璃器皿盛放氢氟酸 | |
| C. | 液氨气化时要吸收大量的热,可用作制冷剂 | |
| D. | 氯化铝是一种电解质,可用氯化铝电解制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
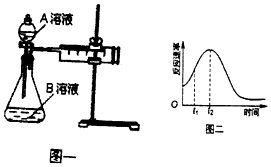
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol•L-1H2C2O4溶液 | 30 mL 0.01 mol•L-1kMnO4溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4溶液 | 30 mL 0.01 mol•L-1KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com