
| A. | CaCl2 | B. | CH3COONa | C. | (NH4)2SO4 | D. | K2CO3 |
分析 A、溶液中含有阴离子种类为氯离子;
B、醋酸钠溶液中阴离子为醋酸根离子,溶液中发生水解反应;
C、溶液中阴离子为硫酸根离子不水解;
D、溶液中阴离子碳酸根离子分步水解.
解答 解:A、溶液中含有阴离子种类为氯离子,氢氧根离子两种;
B、醋酸钠溶液中阴离子为醋酸根离子,溶液中发生水解反应,阴离子为醋酸根离子和氢氧根离子两种;
C、溶液中阴离子为硫酸根离子不水解,阴离子为硫酸根离子和氢氧根离子两种;
D、溶液中阴离子碳酸根离子分步水解,溶液中阴离子为碳酸氢根离子、碳酸根离子、氢氧根离子,三种;
故D含阴离子最多,
故选D.
点评 本题考查了电解质溶液中离子种类,盐类水解分析判断,主要是离子种类的分析,掌握基础是关键,题目较简单.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | (NH4)2SO4 | C. | NH3•H2O | D. | NH4HSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电反应的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电反应的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列关于此电池说法正确的是( )| A. | 充电过程中,当0.1 mol Na+通过离子交换膜时,导线通过0.1 mol电子 | |
| B. | 电池放电时,负极反应为:3NaBr一2e-═NaBr3+2Na+ | |
| C. | 充电过程中钠离子从右到左通过离子交换膜 | |
| D. | 放电过程中钠离子从左到右通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下CH3COONa某溶液的pH=8 | |
| B. | 用CH3COOH溶液做导电实验,灯泡很暗 | |
| C. | 等pH等体积的盐酸、CH3COOH溶液分别与足量锌反应,CH3COOH放出的氢气较多 | |
| D. | 0.1mol•L-1的CH3COOH溶液中含有CH3COOH、CH3COO-、H+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
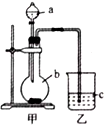 某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.
某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+ | |
| B. | 金属单质导电与电解质溶液导电原因是一样的 | |
| C. | 常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸 | |
| D. | 可用Na与MgCl2溶液反应制Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com