
分析 (1)将反应②×2-①可得2N2H4+2NO2=3N2+4H2O,反应中只有N元素化合价发生变化,为NO2氧化剂,N2H4为还原剂;
(2)将②+③×2+④可得N2H4和H2O2反应生成液态水的热化学方程式,并结合③得到生成气态水的热化学方程式;
(3)将②-⑤×3+⑥×4可得联氨与氟气反应的热化学方程式.
解答 解:(1)将反应②×2-①可得2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7KJ•mol-1,反应中只有N元素化合价发生变化,为NO2氧化剂,N2H4为还原剂,由方程式可知生成3molN2转移8mol电子,只有C错误,
故答案为:C;
(2)将②+③×2+④可得N2H4和H2O2反应生成液态水,反应的热化学方程式为N2H4(g)+2H2O2(1)=N2(g)+4H2O(l)△H=-818.4KJ•mol-1,
则生成气态水的热化学方程式为N2H4(g)+2H2O2(1)=N2(g)+4H2O(g)△H=-642.4KJ•mol-1,
生成1mol液态水放出热量为$\frac{818.4}{4}$kJ=204.6kJ,
故答案为:N2H4(g)+2H2O2(1)=N2(g)+4H2O(g)△H=-642.4KJ•mol-1;204.6;
(3)将②-⑤×3+⑥×4可得联氨与氟气反应的热化学方程式为2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1126kJ•mol-1,
故答案为:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1126kJ•mol-1.
点评 本题考查较为综合,涉及化学反应与能量以及氧化还原反应知识,题目难度中等,注意把握盖斯定律的应用以及热化学方程式的书写.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题

| A. | ②④ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨中含有NH3、NH4+、NH2-微粒 | |
| B. | 其他条件不变,若增加液氨的量,电离平衡将正向移动 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
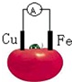
| A. | 铜片为负极 | B. | 铁片上发生还原反应 | ||
| C. | 电子由铁片沿导线流向铜极 | D. | 该装置将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
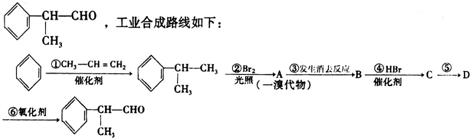
 或
或 .
. .
. +NaOH$→_{△}^{H_{2}O}$NaBr+
+NaOH$→_{△}^{H_{2}O}$NaBr+ ,其反应类型为取代反应.
,其反应类型为取代反应. (或
(或 ).
). 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水久置后黄绿色消失 | |
| B. | 淀粉溶液遇碘单质变蓝 | |
| C. | SO2使品红溶液褪色 | |
| D. | 溴水中加入CCl4溶液,振荡静置后,上层呈橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com