
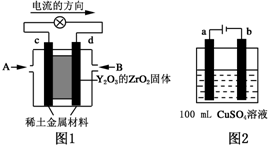
 (1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).
(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).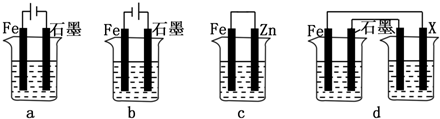
分析 (1)①依据装置图中电流流向分析,c为正极,氧气的电子发生还原反应,d为负极,甲烷失电子发生氧化反应;
②图2是电解池,与电源正极连接的a电极为阳极,发生4OH--4e-═O2↑+2H2O,b为阴极,发生为Cu2++2e-═Cu,结合电极方程式计算;
(2)①原电池的正极和电解池的阴极可以得到保护;
②装置为原电池,若用d装置保护铁,X极的电极材料应比铁活泼;
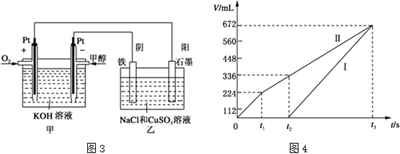
(3)电池通入甲醇的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,根据氧气的量计算氢氧根离子的物质的量,水电离出等物质的量的氢离子和氢氧根离子,根据公式计算得出C(H+),从而得出溶液的pH.
解答 解:(1)①图1是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极,甲烷失电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子,负极电极反应为:CH4+4O2--8e-═CO2+2H2O;
故答案为:正极;CH4+4O2--8e-═CO2+2H2O;
②如图2所示电解100mL0.5mol•L-1CuSO4溶液,发生的电解池反应为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,
若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,pH=-lg0.1=1;
则所得溶液电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,符合恢复溶液浓度的定量关系,但不能加入Cu(OH)2、Cu2(OH)2CO3,因为CuCO3+H2SO4═CuSO4+CO2↑+H2O,相当于加CuO,而Cu(OH)2+H2SO4═CuSO4+2H2O、Cu2(OH)2CO3+2H2SO4═2CuSO4 +CO2↑+3H2O,除增加溶质外还增加了水,故选ac,
故答案为:1;ac;
(2)①装置中原电池的正极和电解池的阴极可以得到保护,a中Fe作阳极被腐蚀,b中Fe作阴极被保护,c中Fe作正极被保护,则bc可以保护铁,故答案为:bc;
②装置为原电池,若用d装置保护铁,X极的电极材料应比铁活泼可以选择锌,故答案为:锌;
(3)①甲醇燃料电池中,在碱性条件下,甲醇失电子生成碳酸根与水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,所以在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O;
t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,t1~t2Ⅱ产生的气体体积=0.336L-0.224L=0.112L,阳极上生成112mL氧气需要n(OH-)=$\frac{0.112L×4mol}{22.4L}$=0.02mol,水电离出等物质的量的氢离子和氢氧根离子,所以n(H+)=0.02mol,c(H+)=$\frac{0.02mol}{0.2L}$=0.1mol/L,所以溶液的pH=1,
故答案为:4OH--4e-=O2↑+2H2O;1.
点评 本题考查了原电池原理和电解池原理,能正确判断电池的类型及两极的反应是解本题的关键,题目难度中等,侧重于学生的分析能力和计算能力的考查,有助于培养学生的逻辑思维能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 铁粉撒入稀硫酸中2Fe+6H+→2Fe3++3H2↑ | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O→AlO2-+4NH4++2H2O | |
| C. | 把金属钠放入冷水中:Na+H2O→Na++OH-+H2↑ | |
| D. | 用氢氧化钠溶液除去铝表面的氧化铝:Al2O3+2OH-→2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 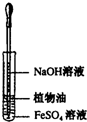 观察Fe(OH)2的生成 | B. | 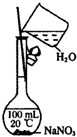 配制一定量浓度的NaNO3的溶液 | ||
| C. | 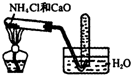 实验室制取氨气 | D. | 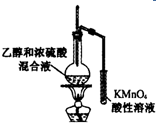 验证乙烯的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
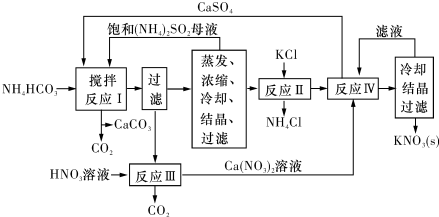
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蓝色石蕊试纸检验溶液的酸性 | |
| B. | 量筒可用于配制溶液,但不能作为反应容器使用 | |
| C. | 配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释 | |
| D. | 向燃着的酒精灯中加酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓烧碱溶液中加入铝片:A1+2OH-+2H2O═[A1(OH)4]-+H2↑ | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3一═CaCO3↓+H2O | |
| C. | 食醋和小苏打溶液混合;CH3COOH+HCO3一═CH3COO-十H2O+CO2↑ | |
| D. | 敞开体系,向FeC12溶液滴加NaOH溶液:4Fe2++8OH-+O2+2H2O═4Fe (OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅能与水反应 | |
| B. | 用二氧化硅制取单质硅,当生成2.24 L(标准状况下)气体时,得到2.8g硅 | |
| C. | 二氧化硅属于传统的无机非金属材料 | |
| D. | 二氧化硅不能与碳酸钠溶液发生反应,但在高温下能与碳酸钠固体发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
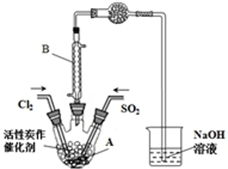 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示. | SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com