
【题目】下列有关物质性质的比较,结论正确的是
A. 溶解度:Na2CO3<NaHCO3
B. 热稳定性:HCl<PH3
C. 沸点:HCl<HBr
D. 碱性:LiOH<Be(OH)2
科目:高中化学 来源: 题型:
【题目】为探究固体A的组成和性质,设计实验并完成如下转化。

已知:X由两种化合物组成,若将X通入品红溶液,溶液褪色。若将X通入足量双氧水中,X可全部被吸收且只得到一种强酸,再稀释到1000mL,测得溶液的PH=1。在溶液2中滴加KSCN溶液,溶液呈血红色。请回答:
(1)固体A的化学式______________。
(2)写出反应①的化学方程式____________。
(3)写出反应④中生成A的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究元素周期律,甲根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的研究;乙根据置换反应的规律,利用下图装置完成O元素的非金属性比S强的研究。回答:
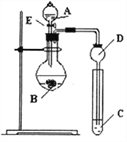
(1)图中A装置名称是______________。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3 溶液 ⑤SiO2
试剂A与C分别为_________(填序号);试管中发生反应的离子方程式为_______________.有同学认为此实验不能说明N、C、S的非金属性强弱,你认为原因是_________________
(3)乙同学设计的实验所用到试剂A为________;如果C试剂为硫化氢的水溶液,则试管中可以观察到的现象为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往1.0 mol·L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)![]() I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是

A.该反应的△H>0
B.a、c两点对应的I-反应速率相等
C.b点时0~10s I-的平均反应速率为0.04mol·L-1·s-1
D.d点时该反应在对应温度下处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所含分子数由多到少的排列顺序是
A.标准状况下33.6L H2
B.物质的量为4mol的 H2
C.20℃,45gH2O
D.常温下,16gO2 与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。

Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO + H2O2= Ca(HCOO)2+ 2H2O + H2↑。实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是__________。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是__________。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是__________。
(4)实验时需强力搅拌45min,其目的是__________;结束后需调节溶液的pH 7~8,其目的是__________。最后经结晶分离、干燥得产品。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:A.甲酸钠,B.5mol·L-1硝酸,c.5mol·L-1盐酸,d.5mol·L-1硫酸,e.3%H2O2溶液,f.澄清石灰水。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
请补充完整由碳酸钙制备甲酸钙的实验步骤:
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2._________。
步骤3._________。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、__________、洗涤、60℃时干燥得甲酸钙晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因电化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是 反应(填“吸热”、“放热”).
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”、“不变”),原因是
(3)反应体系中加入催化剂对反应热是否有影响? (填“有”、“无”),原因是 .
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”、“减小”、“不变”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com