
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)

【答案】 2Cl-+H2O![]() 2OH-+H2↑ +Cl2↑ 阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯 a d
2OH-+H2↑ +Cl2↑ 阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯 a d
【解析】
(1)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl-+H2O![]() 2OH-+H2
2OH-+H2![]() +Cl2
+Cl2![]() ;
;
(2)阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯;
(3)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;Cl2在阳极,根据装置图分析可以知道精制饱和食盐水从阳极进入,即进口为a。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)请写出分子式为C3H5Cl且含碳碳双键的所有同分异构体_______________________。
(2)有机物w分子式为C4H6,且其等效氢只有一种,请写出w所有的结构简式______________。
(3)已知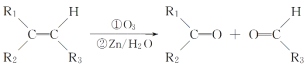 ,某含四元环的有机物发生这个反应后,得到
,某含四元环的有机物发生这个反应后,得到![]() 和
和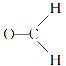 各1mol,请写出该有机物的结构简式_____________。
各1mol,请写出该有机物的结构简式_____________。
(4)已知![]() +NaOH
+NaOH![]() R—CH=CH2+NaCl+H2O请设计由乙烯制备乙炔的方案,无机试剂任意选择,用如下流程图表示反应的流程
R—CH=CH2+NaCl+H2O请设计由乙烯制备乙炔的方案,无机试剂任意选择,用如下流程图表示反应的流程
如:CH3-CH3![]() CH3-CH2Cl
CH3-CH2Cl
______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“摩尔庄园”是一款专门为7﹣12岁儿童设计的安全健康益智网页游戏,它和我们高中化学的“摩尔”没有任何的关系,我们所学的“摩尔”其实是
A.国际单位制中的一个物理量
B.摩尔是表示物质的量
C.摩尔是物质的量的单位
D.摩尔是表示物质数量的单位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200KJ/mol,温度不同(T2>T1)其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素。它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y > Z
C. X与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
D. Z、W元素的最简单氢化物的沸点和稳定性均为H2Z > H2W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)工业合成氨反应:N2+3H2 ![]() 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。
(2)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3
①则用N2表示的化学反应速率为__________________。
②一定条件下,当该反应进行到最大限度时,下列说法正确的是______(填编号)
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1 : 3 : 2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
(3)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______(填“升高”或“降低”)。反应过程____(填“①”或“②”)的能量变化可用图表示。

(4)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:
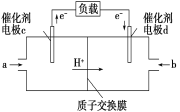
①则d电极是____(填“正极” 或“负极”),c电极的电极反应式为_____________________________。
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,下列热化学方程式书写正确的是( )
A. ![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
B. KOH(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C. 2NaOH(aq)+H2SO4(aq)=== Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
D. KOH(aq)+![]() H2SO4(浓)===
H2SO4(浓)===![]() K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶物质是甲和乙的混合物,已知甲和乙的某些性质如下表所示:
物质 | 熔点/℃ | 沸点/℃ | 密度(g/mL) | 二者的溶解性 |
甲 | -54.6 | 57.7 | 1.49 | 甲乙互溶 |
乙 | -84.3 | 88.5 | 1.53 |
据此,将甲和乙相互分离的比较好的方法是( )
A.萃取法B.过滤法C.蒸馏法D.分液法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com