
 向
向 的转化,请你提出一条可行性建议 。
的转化,请你提出一条可行性建议 。 2CO2+N2。
2CO2+N2。 O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1| 时间/s | 0 | 2 | 3 | 4 |
| c(NO)/mol·L-1 | 1.00×10-3 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
 C(CO)/mol·L-1 C(CO)/mol·L-1 | |  |  2.70×10-3 2.70×10-3 | |
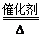 4NO+6H2O(2分) 在NO2中通入过量的空气,然后用水吸收生成硝酸(或其他合理答案)(1分)
4NO+6H2O(2分) 在NO2中通入过量的空气,然后用水吸收生成硝酸(或其他合理答案)(1分)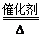 4NO+6H2O,
4NO+6H2O,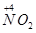 到
到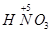 ,工业上是将NO2、过量O2通入H2O中,使得
,工业上是将NO2、过量O2通入H2O中,使得 全被氧化又同时不产生污染性气体。
全被氧化又同时不产生污染性气体。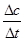 =4.25×10-4mol/(L·s) 注意单位书写
=4.25×10-4mol/(L·s) 注意单位书写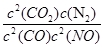 ,表达式中c都是平衡时的浓度。可以求出平衡时各物质的浓度分别为, c(NO)= 1.00×10-4mol/L,c(CO2)= 9.00×10-4 mol/L, C(CO)= 2.70×10-3 mol/L,c(N2)=4.50×10-4 mol/L,代入上式计算可得结果K=5000
,表达式中c都是平衡时的浓度。可以求出平衡时各物质的浓度分别为, c(NO)= 1.00×10-4mol/L,c(CO2)= 9.00×10-4 mol/L, C(CO)= 2.70×10-3 mol/L,c(N2)=4.50×10-4 mol/L,代入上式计算可得结果K=5000

科目:高中化学 来源:不详 题型:计算题
 CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-335.7 kJ·mol-1 | B.-16.3 kJ·mol-1 |
| C.+16.3 kJ·mol-1 | D.-83.7 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2NH3(g)△H<0
2NH3(g)△H<0
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
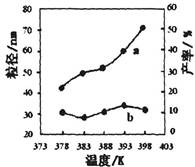
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 4 | 3∶1 | 实验②和④探究________ ______________________ 实验②和__________探究 反应时间对产率的影响。 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | _______ | |
| ④ | 398 | 4 | 4∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。| A.向平衡混合物中充入Ar | B.向平衡混合物中充入O2 |
| C.改变反应的催化剂 | D.降低反应的温度 |
 2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。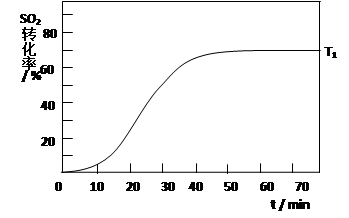
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com