
| 1000ρw |
| M |
| n |
| V |
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |
| 0.1L×1mol/L |
| 18.4mol/L |
| n |
| V |


科目:高中化学 来源: 题型:
| A、NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO3- |
| B、CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 |
| C、等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| D、向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 消耗NaOH溶液的 体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 19.98 | 20.00 |
| 2 | 0.10 | 20.02 | 20.00 |
| 3 | 0.10 | 20.00 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
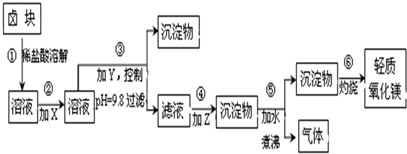
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO1000mL、密度1.19g?cm-3.
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO1000mL、密度1.19g?cm-3.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水振荡,静置分层后,用分液漏斗分离去水层 |
| B、加入氢溴酸并加热,使乙醇转化为溴乙烷 |
| C、加入金属钠,使乙醇发生反应而除去 |
| D、加入浓硫酸并加热到170℃,使乙醇变成乙烯而逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制备有毒气体应在通风橱中进行,且必须对尾气进行吸收或处理 |
| B、浓硝酸需用细口棕色试剂瓶密封保存 |
| C、氢气还原氧化铜,一般先预热氧化铜,然后通入氢气 |
| D、高锰酸钾等药品不能和易燃物同放,且远离火源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Mg2+、NO3-、CO32+ |
| B、Na+、Al3+、Cl-、Mg2+ |
| C、K+、Ba2+、Cl-、HCO3- |
| D、NH4+、Ba2+、Fe3+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解质一定能导电 |
| B、某物质不是电解质就是非电解质 |
| C、非电解质在水溶液中也可能会发生电离 |
| D、强电解质在水溶液中完全以离子形式存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com