
 他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.甲同学研究的实验报告如表:
他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.甲同学研究的实验报告如表:| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快. |
分析 (1)根据表中数据可知,硫酸的浓度相同,不同金属的规格相同,说明实验目的是探究反应物本身对反应速率的影响;影响反应速率的还有温度,所以应该使反应温度相同;
(2)根据图示装置及选取的试剂可知,实验目的是通过测定反应生成氢气快慢进行判断浓度对反应速率的影响.
解答 解:(1)根据表中的信息得出该同学的实验目的是研究反应物本身的性质对反应速率的关系对反应速率的影响;温度对化学反应速率的影响较大,故根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度相同,
故答案为:探究反应物本身的性质对反应速率的影响;温度相同;
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置进行定量实验,图1中药品是金属和酸,浓硫酸和铁发生钝化现象而影响判断,所以完成该实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L稀硫酸,根据v=$\frac{△V}{△t}$知应该测定的实验数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间,
故答案为:Mg(或Fe)和0.5 mol/L硫酸和2 mol/L硫酸;测定一定时间产生气体的体积或测定产生一定体积的气体所需时间.
点评 本题以化学反应速率的影响因素为载体,侧重考查学生猜想、比较、分析、创新、发散思维的能力,难度较大,需认真、细心分析才能正确解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 64gSO2含有硫原子数为2NA | |
| B. | NA个氧分子和NA个氢分子的质量比等于16:1 | |
| C. | 常温常压下,11.2L氧气所含的原子数为NA | |
| D. | 标准状况下,22.4L的水含有NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2发生氧化反应 | B. | Cl2是还原剂 | ||
| C. | 若生成11gCO2,则转移3mol电子 | D. | C失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.03×1022 | B. | 0.15mol | C. | 10.65g | D. | 0.075mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极,电极反应式:2H++2e-═H2↑ | |
| C. | 电解质溶液中,SO42-向正极方向移动 | |
| D. | 外电路电子流入的一极为正极,电子流出的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2溶于水:3NO2+H2O=2H++2NO3-+NO↑ | |
| B. | 用氨水吸收过量的SO2气体:2OH-+SO2=SO32-+H2O | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
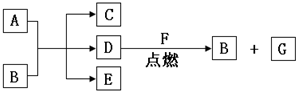
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com