
由五种短周期主族元素组成的单质及化合物(或其溶液),它们的转化关系如下图所示。其中,A、B、C、D、E为单质,常温下A为固体,B、C、D、E为气体;G的焰色反应为黄色;D和E的反应在工农业生产中有重要的意义;K为G和I反应的产物之一。

(1)写出五种单质的名称
(2)I、J相遇反应生成H,反应的现象是 ,化学反应方程式为 ,H物质的电子式为
(3)F的颜色为 ,F和K反应的化学方程式为 。
(4)G和H也可以发生反应,若G和H恰好完全反应,则A、B、C、D、E的物质的量之比为 。
(5)D和E的反应是典型的可逆反应,并且是放热反应。该反应的化学方程式为
请用某两种物质的反应速率间的等量关系表明该反应已经达到化学平衡,该等量关系可以是 ;反应物的总能量E反与生成物的总能量E生的大小关系是:E反 E生。
(20分)每空2分(1)钠 氧气 氯气 氢气 氮气(不论顺序,全对得分)
(2)产生白烟 NH3 +HCl=NH4Cl
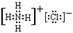
(3)淡黄色 2Na2O2 + 2H2O=4NaOH + O2↑ (4)2:1:1:4:1
(5)N2 + 3H2 2NH3
v(H2)正=3v(N2)逆(其它答案正确同样得分) >(大于)
2NH3
v(H2)正=3v(N2)逆(其它答案正确同样得分) >(大于)
【解析】
试题分析:G的焰色反应为黄色,这说明G中含有钠元素。A、B、C、D、E为单质,常温下A为固体,因此根据AB反应生成F,F和K反应生成G和B可知,A是钠,B是氧气,F是过氧化钠。C、D是气体单质,依据反应条件是光照,推断为氢气和氯气生成氯化氢的反应,即I是氯化氢。D和E的反应在工农业生产中有重要的意义,由此判断该反应应该是合成氨的反应,所以判断D为H2,E为N2,C为Cl2,J是氨气,H是氯化铵。K为G和I反应的产物之一,所以G是氢氧化钠,K是水。
(1)五种单质的名称钠、氧气、氯气、氢气、氮气。
(2)氯化氢和氨气反应产生产生白烟,反应的化学方程式是NH3 +HCl=NH4Cl,生成的氯化铵是含有离子键和共价键的离子化合物,电子式是 。
。
(3)过氧化钠是淡黄色固体,与水反应的化学方程式是2Na2O2 + 2H2O=4NaOH + O2↑。
(4)氢氧化钠和氯化铵恰好反应生成的是一水合氨和氯化钠,则根据原子守恒可知,钠、氧气、氯气、氢气和氮气的物质的量之比=2:1:1:4:1。
(5)合成氨反应的方程式是N2 + 3H2 2NH3。平衡时正逆反应速率相等,则系表明该反应已经达到化学平衡的该等量关系可以是v(H2)正=3v(N2)逆(其它答案正确同样得分) ;因为该反应是放热反应,说明反应物的总能量高于生成物的总能量,即:E反>E生。
2NH3。平衡时正逆反应速率相等,则系表明该反应已经达到化学平衡的该等量关系可以是v(H2)正=3v(N2)逆(其它答案正确同样得分) ;因为该反应是放热反应,说明反应物的总能量高于生成物的总能量,即:E反>E生。
考点:考查无机框图题推断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,对学生的思维能力要求高,有利于培养学生的逻辑推理能力和抽象思维能力。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:




 NH4++OH-
NH4++OH- NH4++OH-
NH4++OH-
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com