
 我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )
我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )| A. | 任何分子式中的“•”都表示氢键 | |
| B. | H2O2是极性分子,其结构简式为HO-OH | |
| C. | H2O2既有氧化性又有还原性 | |
| D. | H2NCONH2与H2O2是通过氢键结合的 |
分析 A.NH3•H2O中的“•”不表示氢键;
B.根据H2O2的正负电荷中心不重合;
C.H2O2的氧元素的化合价为-1价,处于氧元素的中间价态;
D.因结构也没有发生改变,所以尿素 (H2NCONH2)和H2O2通过氢键形成加合物H2NCONH2•H2O2.
解答 解:A.NH3•H2O中的“•”不表示氢键,是化学键,尿素 (H2NCONH2)和H2O2通过氢键形成加合物H2NCONH2•H2O2,故A错误;
B.H2O2的正负电荷中心不重合,所以H2O2是极性分子,其结构简式为HO-OH,故B正确;
C.H2O2的氧元素的化合价为-1价,处于氧元素的中间价态,既有氧化性又有还原性,故C正确;
D.因结构也没有发生改变,所以尿素 (H2NCONH2)和H2O2通过氢键形成加合物H2NCONH2•H2O2,故D正确.
故选A.
点评 本题考查了新型化合物的结构和性质,应注意的是由于双氧水的结构也没有发生改变,这说明是通过氢键连接的,侧重于考查学生对题中信息的应用能力,难度中等.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
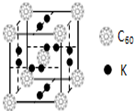 C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮.继C60后,科学家又合成了Si60、N60等球形分子.
C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮.继C60后,科学家又合成了Si60、N60等球形分子.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com