


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A�� | B�� | C�� | D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���Ȼ��� | B�������� | C��̼���� | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��MgSO4 | B��Na2SO3 | C��KMnO4 | D��AlCl3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ľ�Ҳ�����炙��ʹ��̬���� |
| B�����ڳ�ʪ�Ļ��������� |
| C�������Ȼ�����Һ��ɫ���� |
| D��Ũ������Һ�г�ζ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڢ� | B���ۢ� | C���٢� | D���ݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| ũ���� | ˮ�� | ������ | �̲� | ���� | �� | С�� |
| pHֵ | 6-7 | 4.8-5.5 | 5-6 | 7-8 | 6-8 | 6.3-7.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ڢۢ� | B���ڢۢ� | C���٢ڢ� | D���٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
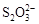

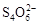 ��2I�D��������ʵ��ܶȻ��������±���
��2I�D��������ʵ��ܶȻ��������±���| ���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2��10��20 | 2.6��10��39 | 1.7��10��7 | 1.3��10��12 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com