
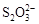

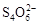 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
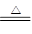 Cu(OH)2·CuCl2+2HCl+2H2O(主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可)
Cu(OH)2·CuCl2+2HCl+2H2O(主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可)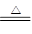 CuO+2HCl↑CuCl2?2H2O晶体在HCl气流中加热脱水
CuO+2HCl↑CuCl2?2H2O晶体在HCl气流中加热脱水 Cu(OH)2·CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl2?2H2O晶体在干燥的HCl气流中加热脱水。(3)滴定前的处理过程中将发生下列反应:2Cu2++4I-=2CuI↓+I2,滴定过程中I2消失是滴定的终点,所以可选用淀粉溶液做指示剂,滴定终点为:蓝色褪去,且在半分钟内不恢复颜色;从反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=S4O62-+2I-,可知Cu2+~S2O32-,n(Cu2+)="0.100" mol/L×0.020 L=2×10-3 mol,m(CuCl2·2H2O) =2×10-3 mol×171 g/mol =0.342g,则试样中CuCl2·2H2O的含量为95%。
Cu(OH)2·CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl2?2H2O晶体在干燥的HCl气流中加热脱水。(3)滴定前的处理过程中将发生下列反应:2Cu2++4I-=2CuI↓+I2,滴定过程中I2消失是滴定的终点,所以可选用淀粉溶液做指示剂,滴定终点为:蓝色褪去,且在半分钟内不恢复颜色;从反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=S4O62-+2I-,可知Cu2+~S2O32-,n(Cu2+)="0.100" mol/L×0.020 L=2×10-3 mol,m(CuCl2·2H2O) =2×10-3 mol×171 g/mol =0.342g,则试样中CuCl2·2H2O的含量为95%。

科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O |
| B.Cu2+ + H2S = CuS↓+ 2H+ |
| C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑ |
| D.FeS + 2H+= Fe2+ + H2S↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种难溶物中溶解度小的物质其KSP不一定小 |
| B.同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C.因为Ksp(BaSO4)= 1.08×l0-l0,Ksp(BaCO3)=8.1×10-9,所以BaSO4沉淀不可能转化为BaCO3沉淀 |
| D.相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1·L-l盐酸、②0.1mo1·L-1氯化镁溶液、③0.1mo1·L-l l硝酸银溶液中,c(Ag+):③>②>① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaCO3的溶解度小于CaSO4 |
| B.沉淀转化的实质是沉淀溶解平衡的移动 |
| C.沉淀转化的难易与溶解度差别的大小无关 |
| D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp = 6.8×10-37
5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp = 6.8×10-37| A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿 |
| B.由上述平衡可知,小孩长牙时要少吃糖多补钙 |
| C.若减小OH-的浓度,上述平衡将向右移动,Ksp的值相应增大 |
| D.使用含氟牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.36×10-5 mol·L-1 |
| B.8.90×10-6 mol·L-1 |
| C.4.45×10-2 mol·L-1 |
| D.1×10-5 mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com