

分析 由实验流程可知,Fe3O4、Al2O3、CuO三者混合物中加入试剂Ⅰ为氢氧化钠溶液,Fe3O4、CuO不反应,Al2O3可与NaOH溶液反应生成溶液Ⅰ为NaAlO2,滤渣Ⅰ为Fe3O4、CuO,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和溶液Ⅱ为碳酸氢钠溶液,Al(OH)3沉淀煅烧得Al2O3,Al2O3电解得单质C为Al,Fe3O4、CuO中加入过量盐酸得溶液Ⅲ为FeCl2、FeCl3、CuCl2,溶液Ⅲ中加入过量的双氧水将亚铁离子氧化成铁离子,调节PH值得固体D为Fe(OH)3,Fe(OH)3受热分解得E为氧化铁,溶液Ⅳ为氯化铜溶液,经过蒸发浓缩、冷却结晶,得到的氯化铜晶体,据此答题.
解答 解:由实验流程可知,Fe3O4、Al2O3、CuO三者混合物中加入试剂Ⅰ为氢氧化钠溶液,Fe3O4、CuO不反应,Al2O3可与NaOH溶液反应生成溶液Ⅰ为NaAlO2,滤渣Ⅰ为Fe3O4、CuO,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀和溶液Ⅱ为碳酸氢钠溶液,Al(OH)3沉淀煅烧得Al2O3,Al2O3电解得单质C为Al,Fe3O4、CuO中加入过量盐酸得溶液Ⅲ为FeCl2、FeCl3、CuCl2,溶液Ⅲ中加入过量的双氧水将亚铁离子氧化成铁离子,调节PH值得固体D为Fe(OH)3,Fe(OH)3受热分解得E为氧化铁,溶液Ⅳ为氯化铜溶液,经过蒸发浓缩、冷却结晶,得到的氯化铜晶体,
(1)溶液Ⅰ为NaAlO2溶液,向溶液Ⅰ中通入过量气体A为二氧化碳可以得到两种治疗胃酸过多的药物,该反应的离子方程式是AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,溶液Ⅱ为碳酸氢钠溶液,将溶液Ⅱ小心蒸干可得俗名为 小苏打的酸式盐,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-; 小苏打;
(2)铝和氧化铁反应生成氧化铝和铁,证明二者反应后的混合物中含有铝,可以用氢氧化钠溶液反应,看是否有气体产生,若有气体,则说明有铝存在,故选b,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:b;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)溶液Ⅲ中加含有亚铁离子,向其中加入H2O2后反应的离子方程式是H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)工业上用电解法制钠,故选b;
(5)由CuCl2溶液获得CuCl2•2H2O的方法 是在氯化氢气流中蒸发浓缩,冷却结晶,过滤,
故答案为:在氯化氢气流中蒸发浓缩,冷却结晶,过滤;
(6)溶液Ⅲ中含有亚铁离子和氯离子,都能使酸性高锰酸钾溶液褪色,所以溶液紫色褪去不能说明溶液Ⅲ中含有Fe2+,
故答案为:不能;溶液中的氯离子也可以使酸性高锰酸钾溶液褪色.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中的反应、混合物分离方法等为解答的关键,侧重分析与实验能力的考查,注意Fe、Al及其化合物的性质,题目难度不大.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 导致易拉罐变瘪的离子反应是:CO2+OH-═HCO3- | |
| B. | 导致易拉罐又鼓起来的反应是:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| C. | 若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 | |
| D. | 反应结束后,易拉罐内溶液中的溶质只有Na[Al(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
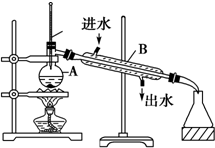 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题| 物质 | 熔点/℃ | 沸点/℃ | 密度 /g•cm-3 | 溶解性 |
| 乙二醇 (C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水 和乙醇 |
| 丙三醇 (C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 主族元素原子的最外层电子数越多,元素的金属性越强 | |
| B. | C、N、0、F元素的单质与氢气化合越来越剧烈 | |
| C. | 图是元素周期表中碘元素的部分信息,可知该碘原子的质量数为126.9 | |
| D. | 元素在周期表中的族序数与该元素原子电子层数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 两步反应均为吸热反应 | |
| B. | 加入催化剂不会改变 A→C 的反应热 | |
| C. | 三种化合物中 C 最稳定 | |
| D. | 整个反应中△E=E4-E1-E2-E3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10L0.1mol•L-1的氨水中含有NA个NH4+ | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,22.4L四氯化碳中含有NA个CCl4分子 | |
| D. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫和二氧化氮是引起酸雨的主要气体 | |
| B. | 金属钠、电石着火时,直接用高压水枪喷水扑灭 | |
| C. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| D. | 家庭中洁厕灵与“84消毒液”不能同时使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com