
【题目】相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
科目:高中化学 来源: 题型:
【题目】对下列事实的解释正确的是
A. 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B. 分别用盛满HC1气体和盛满NO2气体的烧瓶做喷泉实验,喷泉结束后,所得溶液的物质的量浓度相同
C. 向50mL 18 mol/L的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D. 常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-![]() H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.c(Na+)=c(HB-)+c(B2-)+c(H2B)
D.NaHB和NaOH溶液反应的离子方程式为:H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,最终的白色沉淀不一定是BaSO4的是
A. Ba(NO3)2溶液![]() 白色沉淀
白色沉淀
B. 无色溶液液![]()
![]() 白色沉淀
白色沉淀
C. Ba(NO3)2溶液![]() 无现象
无现象![]() 白色沉淀
白色沉淀
D. Ba(NO3)2![]()
![]()
![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应 Fe(s) + CO2(g) ![]() FeO(s) + CO(g),△H=aKJ﹒mol-1,平衡常数为K。测得在不同温度下,K值如下:
FeO(s) + CO(g),△H=aKJ﹒mol-1,平衡常数为K。测得在不同温度下,K值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.4 |
(1)若500℃时进行反应①,CO2的起始浓度为2mol﹒L-1,CO的平衡浓度为__________。
(2)该反应为__________(选填“吸热”或“放热”)反应。
(3)700℃时反应达到平衡,要使该平衡向右移动,其他条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应器体积 B.CO2 C.升高温度到900℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合该反应的是__________(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
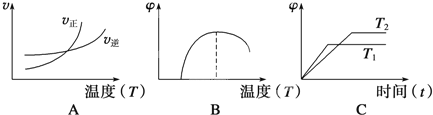
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
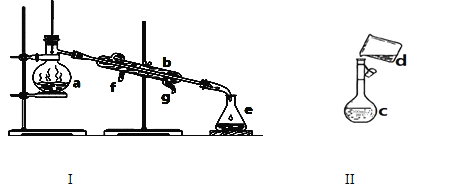
(1)写出下列仪器的名称:
a.________b._______ c._________。
(2)仪器a~e中,使用前必须检查是否漏水的有_________________。(填序号)
(3)现需配制0.1mol/LNaOH溶液450ml,装置II是某同学转移溶液的示意图。
①图中的错误是_______________。除了图中给出的仪器和托盘天平外,为完成实验还需要的仪器有:______
②根据计算得知,所需NaOH的质量为_______g。
③配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________________。
a.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
b.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
c.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
d.将容量瓶盖紧,振荡,摇匀
e.改用胶头滴管加水,使溶液凹面恰好与刻度相切
f.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质类比正确的是( )
A. 已知Fe+S![]() FeS,则Cu+S
FeS,则Cu+S![]() CuS
CuS
B. Fe能与CuSO4溶液反应,可知Al与CuSO4溶液也能反应
C. CaSO3与稀盐酸反应生成SO2,可知CaSO3与稀硝酸反应也生成SO2
D. 已知H2O2能氧化I-,可知H2O2也能氧化Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式
A________;B________;C________;D________;E________;F________。
(2)写出F和H反应的化学方程式___________________。
(3)写出下列反应的离子方程式:
①D+盐酸____________________;
②B+水______________________;
③D+A_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡.当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的KW相似).如:
AgX(s)![]() Ag+(aq)+X-(aq);Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
Ag+(aq)+X-(aq);Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
AgY(s)![]() Ag+(aq)+Y-(aq);Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
Ag+(aq)+Y-(aq);Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s)![]() Ag+(aq)+Z-(aq);Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
Ag+(aq)+Z-(aq);Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为 。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-) (填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为 。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由: ②在上述(3)体系中,能否实现AgY向AgX的转化?根据你的观点选答一项.若不能,请简述理由: ,若能,则实验转化的必要条件是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com