解:(1)没有450mL容量瓶,故选择500mL容量瓶,
配制500mL0.4mol/L的NaOH溶液需要的仪器有:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故还需要玻璃棒,容量瓶使用前需要检查容量瓶是否漏水,
故答案为:500mL;玻璃棒;检查容量瓶是否漏水;
(2)需氢氧化钠的质量为m=0.5L×0.4mol?L
-1×40g/mol=8.0g,氢氧化钠具有强腐蚀性、易潮解,应在烧杯内迅速称量.
故答案为:8.0;烧杯;
(3)①在未降至室温时,立即将溶液转移至容量瓶定容,溶液具有热胀冷缩性质,冷却后对所配溶液体积偏小,所配溶液浓度偏高,
故答案为:偏高;
②定容后,加盖倒转摇匀后,发现液面低于刻度线,少量溶液残留在瓶塞与瓶口之间,又滴加蒸馏水至刻度,溶液的体积偏大,所配溶浓度偏低,
故答案为:偏低;
(4)溶液是均匀的,取出溶液浓度与原溶液浓度相同为0.4mol/L,
根据稀释定律,稀释前后溶质的物质的量不变,故稀释后溶液中氢氧化钠的质量为0.05L×0.4mol?L
-1×40g/mol=0.8g,
发生反应NaOH+HCl=NaCl+H
2O,由方程式可知n(HCl)=n(NaOH)=0.05L×0.4mol?L
-1=0.02mol,故需要盐酸的体积为
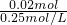
=0.08L=80mL,
故答案为:0.4;0.8;80.
分析:(1)没有450mL容量瓶,故选择500mL容量瓶,配制500mL0.4mol/L的NaOH溶液需要的仪器有:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
容量瓶使用前需要检查是否漏水;
(2)利用n=cv计算出氢氧化钠的物质的量,再根据m=nM计算所需氢氧化钠的质量;
氢氧化钠具有强腐蚀性、易潮解,应在烧杯内迅速称量;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=

分析对所配溶液浓度的影响;
(4)溶液是均匀的,取出溶液浓度与原溶液浓度相同;
根据稀释定律,稀释前后溶质的物质的量不变,利用n=cv计算出氢氧化钠的物质的量,再根据m=nM计算氢氧化钠的质量;
发生反应NaOH+HCl=NaCl+H
2O,由方程式可知n(HCl)=n(NaOH),再根据V=
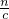
计算需要盐酸的体积.
点评:本题考查了一定物质的量浓度溶液的配制、物质的量的有关计算等,注意从c=

理解配制原理,注意腐蚀性易潮解的药品应放在玻璃器皿内迅速称量.

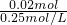 =0.08L=80mL,
=0.08L=80mL, 分析对所配溶液浓度的影响;
分析对所配溶液浓度的影响;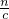 计算需要盐酸的体积.
计算需要盐酸的体积. 理解配制原理,注意腐蚀性易潮解的药品应放在玻璃器皿内迅速称量.
理解配制原理,注意腐蚀性易潮解的药品应放在玻璃器皿内迅速称量. 

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案