
【题目】海藻中含有丰富的、以离子形式存在的碘元素。如图是实验室从海藻里提取碘的流程中的一部分。

下列判断正确的是( )
A.步骤①③的操作分别是过滤、萃取
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤③中加入的有机溶剂是四氯化碳或乙醇
D.步骤④的操作是过滤
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于反应3B(g) ![]() C(g)+D(g)的说法不正确的是( )
C(g)+D(g)的说法不正确的是( )
A.某时刻测得v正(B)=v逆(B),说明反应达到了化学平衡状态
B.反应达到化学平衡后,反应物和生成物的浓度不再改变
C.反应达到平衡后,反应就停止了
D.上述反应中,B不可能全部转化为C和D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的容器中发生反应X(g)+3Y(g) ![]() aZ(g) △H<0,各组分浓度如下表
aZ(g) △H<0,各组分浓度如下表
物质 | X | Y | Z |
初始浓度/ mol·L-1 | 0.1 | 0.3 | 0 |
2min末浓度/mol·L-1 | 0.08 | 0.04 | |
平衡浓度/mol·L-1 | 0.1 |
(1)0~2min的平均速率ν(Y) =___________________
(2)达平衡时X的转化率为___________________
(3)a =_______________
(4)平衡时Y的浓度为________________
(5)下列能表示该反应一定达到平衡状态的______________
①单位时间内生成n mol X的同时生成n mol Z
②c(X):c(Y):c(Z)的比值不再变化
③容器中的气体的质量不再变化
④容器中混合气体的平均相对分子质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息回答下列问题:
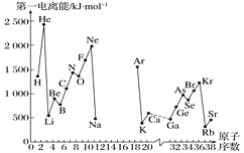
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
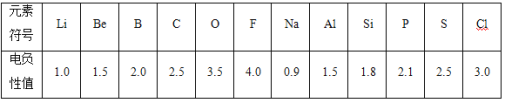
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<________(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是______________:
(3)信息A图中第一电离能最小的元素在周期表中的位置是_______周期__________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有_______性,其中Be(OH)2显示这种性质的离子方程式是____________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围_________。
(6)请归纳元素的电负性和金属性、非金属性的关系是__________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物___________,说出理由并写出判断的方法_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上。
①金刚石与“足球烯”、C60;②氧气(O2)与臭氧(O3);③16O、17O和18O;④CH4和CH3CH2CH3;
⑤乙烯和乙烷;⑥![]() 和
和![]() ;⑦
;⑦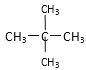 和
和![]() ;
;
(1)同位素___,
(2)同系物___,
(3)同分异构体___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应:2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:


①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________(“增大”或“减小”)。
(2)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的ΔH______0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为__________________;平衡时混合气体中NO2的体积分数为_______。
②100℃时达平衡后,向容器中迅速充入含0.08mol的NO2和0.08mol N2O4 的混合气体,此时速率关系v(正)____v(逆)。(填“大于”,“等于”,或“小于”)
③100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a.T________100℃(填“大于”或“小于”),判断理由是____________________
b.列式计算温度T时反应的平衡常数K2(写计算过程):______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝在工业生产中有多种用途。请根据信息回答:
(1)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN)
己知:2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351 kJ·mol-1
2C(s)+O2 (g)=2CO(g); △H2=-221 kJ·mol-1
2Al(g)+N2(g)=2AlN(s) △H3=-318 kJ·mol-1
则碳热还原法合成AlN的热化学方程式为_____。
(2)电解氧化铝生产铝时,阳极产生的副产物CO2,可通过CO2甲烷化再利用,反应原理为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H4。
CH4(g)+2H2O(g) △H4。
常压下以Ru/TiO2作催化剂,在恒容且容积相同的不同容器中,分别充入10mol CO2和H2的混合气体(体积比1:4)于不同温度下进行反应,第tmin时分别测定CH4的体积分数![]() ,并绘成如图甲所示曲线。
,并绘成如图甲所示曲线。
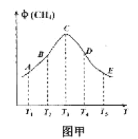
①A、B、C、D、E五点中,尚未达到平衡的点是___,该反应的△H4__0(填“>”或“<”)。
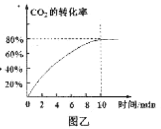
②350℃时,在2L恒容密闭容器中测得CO2的平衡转化率如图乙所示,则前10 min的平均反应速率v(CO2)=___;平衡常数为____
(3)据文献报道,科学家利用氮化镓材料与铜组成如图所示的人工光合系统装置,成功地以CO2和H2O为原料合成了CH4。
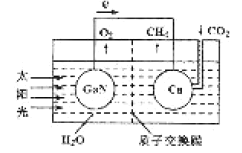
①写山铜电极表面的电极反应式____。
②为提高该人工光合系统的工作效率,可向装置中加入少量__(选填“盐酸”或“硫酸”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com