
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上。
①金刚石与“足球烯”、C60;②氧气(O2)与臭氧(O3);③16O、17O和18O;④CH4和CH3CH2CH3;
⑤乙烯和乙烷;⑥![]() 和
和![]() ;⑦
;⑦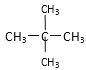 和
和![]() ;
;
(1)同位素___,
(2)同系物___,
(3)同分异构体___。
【答案】③ ④⑥ ⑦
【解析】
①金刚石与“足球烯”、C60是碳元素组成的不同单质,互为同素异形体;②氧气(O2)与臭氧(O3)是氧元素组成的不同单质,互为同素异形体;③16O、17O和18O是氧元素的不同核素,互为同位素;④CH4和CH3CH2CH3,两者结构相似,分子组成相差一个CH2原子团,互为同系物;⑤乙烯和乙烷是两种不同物质;⑥![]() 和
和![]() ,两者结构相似,分子组成相差一个CH2原子团,互为同系物;⑦
,两者结构相似,分子组成相差一个CH2原子团,互为同系物;⑦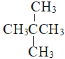 和
和![]() ,两者分子式相同,结构式不同,互为同分异构体。
,两者分子式相同,结构式不同,互为同分异构体。
⑴同位素是质子数相同,中子数不同的不同核素互称, 16O、17O和18O是氧元素的不同核素,故答案为:③。
⑵同系物是结构相似,分子组成相差一个或若干个CH2原子团,④CH4和CH3CH2CH3; ⑥![]() 和
和![]() ,两组结构分别相似,分子组成相差一个CH2原子团,互为同系物;故答案为:④⑥。
,两组结构分别相似,分子组成相差一个CH2原子团,互为同系物;故答案为:④⑥。
⑶同分异构体是分子式相同,结构式不同,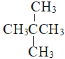 和
和![]() 两者分子式相同,结构式不同,互为同分异构体;故答案为:⑦。
两者分子式相同,结构式不同,互为同分异构体;故答案为:⑦。


科目:高中化学 来源: 题型:
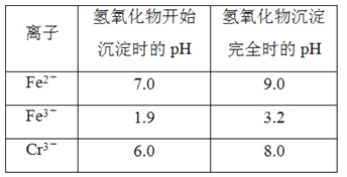
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
(1)某含铬废水处理的主要流程如图所示:
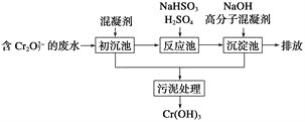
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
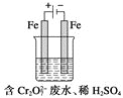
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=[(CO2)·(H2)]/[(CO)·(H2O)]在不同的温度下该反应的平衡常数如下表所示:

下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
C. 某温度下,如果平衡浓度符合下列关系式:(CO2)/3(CO)=(H2O)/5(H2),判断此时的温度是1 000 ℃
D. 该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的、以离子形式存在的碘元素。如图是实验室从海藻里提取碘的流程中的一部分。

下列判断正确的是( )
A.步骤①③的操作分别是过滤、萃取
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤③中加入的有机溶剂是四氯化碳或乙醇
D.步骤④的操作是过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是

A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1 L1 mol·L-1HCl溶液中含有NA个HCl分子
C. 12.0 g熔融的NaHSO4中含有的阳离子数为0.1NA
D. 1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2 NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含锌废渣及粉尘是危险废物,碱浸电解法处理可得锌粉。但若其中存在氯,则锌质量就严重下降,对电极板也有严重腐蚀作用。工业上模拟碱浸电解法处理含锌质量分数为16%的废料(主要成分为ZnO、Zn(OH)2、ZnSO4及PbCO3、Fe2O3、Cu杂质)工艺如图:
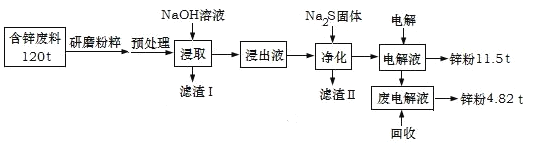
ⅰ.浸出液中含有[Zn(OH)4]2-和[Pb(OH)4]2-等离子
ⅱ.滤渣Ⅱ的主要成分为:Na2Pb(OH)xS![]()
(1)从物质分类的角度看,ZnO属于__,其与NaOH溶液发生反应的离子方程式为__。
(2)“滤渣Ⅰ”的主要成分为___。
(3)下表是“预处理”的2种除氯方案中粉尘氯的去除率和锌损失率分析表格可知,首选的“除氯剂”为___,原因是____。
除氯剂 | 碱(NaOH) | 碳酸钠 |
氯去除率/% | 78.75 | 83.69 |
锌损失率/% | 0.26 | 0.28 |
价格/t | 7200元 | 3600元 |
(4)“电解”过程中阴极的电极反应式为____。
(5)锌的总回收率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ.(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为________________________。
(2)已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
Ⅱ.已知水的电离平衡曲线如图所示,试回答下列问题:
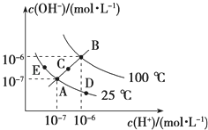
(3)图中五点KW间的关系是__________________.
(4)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(5)E对应的温度下,在pH=9的NaOH溶液与pH=4的H2SO4 溶液中,水电离出的H+浓度之比为:________,若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s) ![]() bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
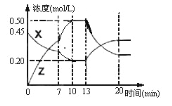
A. 根据上图可求得方程式中a∶b=1:3
B. 推测在第7min时曲线变化的原因可能是升温
C. 推测在第13min时曲线变化的原因可能是降温
D. 用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com