
【题目】已知某化学反应的平衡常数表达式为K=[(CO2)·(H2)]/[(CO)·(H2O)]在不同的温度下该反应的平衡常数如下表所示:

下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
C. 某温度下,如果平衡浓度符合下列关系式:(CO2)/3(CO)=(H2O)/5(H2),判断此时的温度是1 000 ℃
D. 该反应为吸热反应
【答案】B
【解析】
A、平衡常数表达式是生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,因此根据平衡常数表达式为K=[(CO2)·(H2)]/[(CO)·(H2O)]可知该反应的化学方程式为CO(g)+H2O(g)![]() CO2(g)+H2(g),故A正确;
CO2(g)+H2(g),故A正确;
B、若在一定体积的密闭容器中通入CO2和H2各1 mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,则
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) 0 0 1 1
变化量(mol) 0.6 0.6 0.6 0.6
平衡量(mol) 0.6 0.6 0.4 0.4
反应前后气体物质的量不变,可以用其物质的量代替平衡浓度计算,则浓度熵Q=![]() =0.44<K=1,此时反应没有达到平衡,故B错误;
=0.44<K=1,此时反应没有达到平衡,故B错误;
C、如果平衡浓度符合下列关系式:(CO2)/3(CO)=(H2O)/5(H2),则此时温度下平衡常数K=[c(CO2)·c(H2)]/[(CO)·c(H2O)]=3/5=0.6,因此温度是1000℃,故C正确;
D、由表中数据可知,该反应的化学平衡常数随温度升高而增大,故该反应为吸热反应,D正确;
答案选B。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。下列有关说法正确的是( )
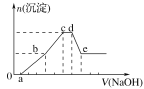
A.在0~a段加入的NaOH溶液与NH4Cl反应
B.在b~c段加入NaOH溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓
C.在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-===AlO2-+2H2O
D.在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:

填写下列空白:
(1)甲中不含氧原子的官能团是___;下列试剂能与甲反应而褪色的是___(填字母)。
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:____。
(3)已知:C2H5Br+NaOH![]() CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
淀粉![]() A
A![]() B(C2H5OH)
B(C2H5OH)![]() C(C2H4)
C(C2H4)![]() D(C2H4Br2)
D(C2H4Br2)![]() 乙
乙
①A的分子式是____,试剂X可以是_____。
②写出由D生成乙化学方程式:_______。
(4)已知:
 +HCl(-R为羟基)
+HCl(-R为羟基)
 +H2
+H2
根据已有知识并结合相关信息,写出以苯、乙烯、氯化氢为原料制备丙的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3______。
CH3COOCH2CH3______。
(5)写出丙在引发剂的条件下生成高分子化合物的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的容器中发生反应X(g)+3Y(g) ![]() aZ(g) △H<0,各组分浓度如下表
aZ(g) △H<0,各组分浓度如下表
物质 | X | Y | Z |
初始浓度/ mol·L-1 | 0.1 | 0.3 | 0 |
2min末浓度/mol·L-1 | 0.08 | 0.04 | |
平衡浓度/mol·L-1 | 0.1 |
(1)0~2min的平均速率ν(Y) =___________________
(2)达平衡时X的转化率为___________________
(3)a =_______________
(4)平衡时Y的浓度为________________
(5)下列能表示该反应一定达到平衡状态的______________
①单位时间内生成n mol X的同时生成n mol Z
②c(X):c(Y):c(Z)的比值不再变化
③容器中的气体的质量不再变化
④容器中混合气体的平均相对分子质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
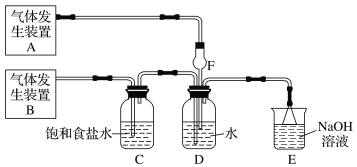
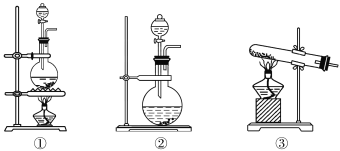
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L1)为原料制取Cl2。在此实验中,F仪器的作用是________;发生装置B应选择以下三种装置中的________(填序号),发生反应的化学方程式是___________________。
(2)D装置中主要反应的离子方程式为_________________________________。
(3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④酸性高锰酸钾溶液若Cl2过量,取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,再加入_______(选填一个序号)试剂。发生的现象是___________________________。若SO2过量,取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,发生的现象是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息回答下列问题:
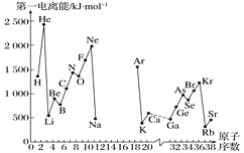
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
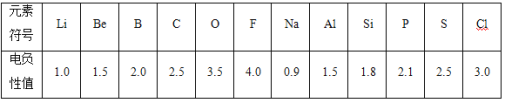
(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<________(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是______________:
(3)信息A图中第一电离能最小的元素在周期表中的位置是_______周期__________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有_______性,其中Be(OH)2显示这种性质的离子方程式是____________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围_________。
(6)请归纳元素的电负性和金属性、非金属性的关系是__________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物___________,说出理由并写出判断的方法_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上。
①金刚石与“足球烯”、C60;②氧气(O2)与臭氧(O3);③16O、17O和18O;④CH4和CH3CH2CH3;
⑤乙烯和乙烷;⑥![]() 和
和![]() ;⑦
;⑦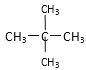 和
和![]() ;
;
(1)同位素___,
(2)同系物___,
(3)同分异构体___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从本质入手看物质及其能量的变化,可以让我们更加深入的去理解所学知识的内涵及外延应用。对于《原电池》这部分知识也是如此,如图是原电池的基本构造模型:

(1)若a和b的电极材料为Al或Mg。
①若c为稀NaOH溶液时,则a的电极材料为__,该极电极方程式为___。
②若c为稀H2SO4时,则a的电极材料为___,该极电极方程式为__。
(2)对于原电池的应用,以下说法正确的是__。
A.选择构成原电池两极材料时,必须选择活泼性不同的两种金属材料
B.构成原电池时,负极材料的活泼性一定比正极材料的强
C.构成原电池时,作为负极材料的金属受到保护
D.从能量转化角度去看,如图的氧化还原反应能量变化曲线,则不能够设计原电池

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com