
| A. | AgI,AgBr,AgCl | B. | AgCl,AgI,AgBr | C. | AgBr,AgI,AgCl | D. | AgCl,AgBr,AgI |
分析 组成相似的难溶电解质,溶解度与溶度积成正比,则Ksp越大溶解度越大;当含有等物质的量浓度的Cl-、Br-、I-,逐滴加入AgNO3溶液时,溶解度较小的首先沉淀,也可以利用浓度积与Ksp关系解决此问题.
解答 解:方法①:利用组成相似的难溶电解质,溶解度与溶度积成正比,即Ksp越大溶解度越大.所以AgCl、AgBr、AgI溶解度逐渐减小.沉淀顺序为AgI、AgBr、AgCl,即A正确;
方法②:等物质的量浓度的Cl-、Br-、I-,逐滴加入AgNO3溶液时AgCl、AgBr、AgI三者的浓度积Qc相等,因为Ksp(AgI)最小,所以首先Qc>Ksp的为AgI,其次为AgBr,最后为AgCl,则沉淀顺序为:AgI、AgBr、AgCl,即A确,
故选A.
点评 本题考查难溶电解质的沉淀出现与Ksp或者溶解度有关系,题目难度不大,明确溶度积与沉淀的转化、生成和溶解的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 海水中蕴藏有丰富的资源,人类可以大量开发,以弥补资源的短缺 | |
| B. | 海水可以成为廉价的资源基地,但要合理开发,综合利用 | |
| C. | 可以用太阳能电解海水以获取氢能源 | |
| D. | 人类在利用海水时要兼顾海洋生物和海洋生态平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2CO3、NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO、NO都是大气污染气体,在空气中都能稳定存在 | |
| D. | Fe和Al都是金属,都不能与碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
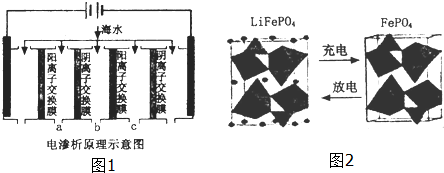
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的晶体模型: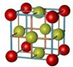 | |
| B. | 铍原子最外层的电子云图: | |
| C. | 次氯酸的结构式:H-O-Cl | |
| D. | CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D氢化物的稳定性比B氢化物的稳定性强 | |
| B. | 5种元素中,E元素氧化物的水合物的酸性最强 | |
| C. | A与B、D分别可形成AB2、AD2的化合物 | |
| D. | B和C可形成离子化合物,且C离子的半径大于B离子的半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com