
(15分)下表是元素周期律的一部分。根据表中的10种元素,用元素符号或化学式填空。
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
① |
|
② |
③ |
|
|
3 |
⑧ |
|
⑨ |
④ |
|
⑤ |
⑥ |
⑦ |
|
4 |
|
|
|
|
|
|
⑩ |
|
(1)在 ①~⑩ 元素中金属性最强的金属元素是 ;第一电离能最小的元素是 ;电负性最强的元素是
(2)在 ①~⑩ 元素的最高价氧化物的水化物呈两性的是 ;⑥形成的最高价氧化物的水化物的分子式是 ;
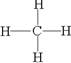
(3)①形成的气态氢化物的结构式是 ;其中心原子采取 杂化,空间构型为
(4)①和②形成的化合物是 晶体,电子式是 ;①和④、②和④可形成 (填“离子”或“共价”)化合物,是 晶体,熔点高的是 ,理由 。
(1)Na
Na F (2)Al(OH)3 HClO4
(3)  SP3
正四面体
SP3
正四面体
(4)分子 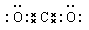 共价 原子 二氧化硅 形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量。
共价 原子 二氧化硅 形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量。
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表的位置可判断,①~⑩分别是C、O、F、Si、S、Cl、Ar、Na、Al、Br。
(1)金属性越强,第一电离能越小,是最小的是Na。非金属性越强,电负性越大,因此是F。
(2)氢氧化铝是两性氢氧化物,Cl最高价是+7价,所以最高价氧化物的水化物的化学式为HClO4.
(3)碳的氢化物是甲烷,属于正四面体型,碳原子采取的是sp3杂化,结构式为 。
。
(4)C和O形成的CO2是分子晶体,含有极性键,电子式为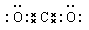 。C和Si通过极性键形成共价化合物SiC,是原子晶体,熔点高。这是由于形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量,所以熔点很高。
。C和Si通过极性键形成共价化合物SiC,是原子晶体,熔点高。这是由于形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量,所以熔点很高。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | H | IIA | IIIA | IVA | VA | VIA | VIIA | He |
| 2 | Li | Be | B | C | N | O | F | Ne |
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar |


查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① |
|
|
|
|
|
|
二 | ② | ③ | ④ |
| ⑤ | ⑥ |
|
三 |
| ⑦ | ⑧ |
|
| ⑨ | ⑩ |
(1)表中元素⑩的氢化物的化学式为________________,此氢化物的还原性比元素⑨的氢化物的还原性________________。(填“强”或“弱”)
(2)某元素原子的核外K层电子数比L层电子数少5,则该元素的元素符号是__________,其单质与⑦的反应方程式为_______________________________________________________。
(3)俗称为“矾”的一类化合物通常含有共同的元素是________________________。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式____________________________________________________________。
又如表中与元素⑦的性质相似的不同族元素是____________。(填元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① |
|
|
|
|
|
|
二 | ② | ③ | ④ |
| ⑤ | ⑥ |
|
三 |
| ⑦ | ⑧ |
|
| ⑨ | ⑩ |
(1)表中元素⑩的氢化物的化学式为________________,此氢化物的还原性比元素⑨的氢化物的还原性________________。(填“强”或“弱”)
(2)某元素原子的核外K层电子数比L层电子数少5,则该元素的元素符号是__________,其单质与⑦的反应方程式为_______________________________________________________。
(3)俗称为“矾”的一类化合物通常含有共同的元素是________________________。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式____________________________________________________________。
又如表中与元素⑦的性质相似的不同族元素是____________。(填元素符号)
查看答案和解析>>
科目:高中化学 来源:2015届北京市东城区(南片)高一下学期期末考试化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。

(1)在以上字母表示的短周期主族元素中,原子半径最大的是__________(填元素符号)。
(2)i元素在周期表中的位置是__________。运用元素周期律判断,i元素的正二价硫酸盐是__________(难溶或易溶)于水的固体。
(3)请用电子式表示a与g组成的化合物的形成过程____________________。
(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式____________________;X与d的单质在加热条件下生成的化合物中存在的化学键类型是____________________。
(5)工业上制取Y和g的无水化合物方法如下:Y的氧化物与b、g的单质在高温条件下反应,每消耗6 kg b的单质,过程中转移1×10 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com