
����Ŀ��E��һ����Ҫ�ĸ߷���������ϳ���·��ͼ1��ʾ������A�DZ���ͬϵ�1molA��1mol���ֱ���ȫȼ��ʱ��A�ȱ�������3molO2 �� A�ĺ˴Ź���������3��壻B��X��Ϊͬ���칹�壻1molC����������Ӧʱ���ɵõ�4molAg��
��֪������ͼ2��ʾ��
��1��A�������� �� 1molB�������molNaOH��
��2������X�Ľṹ��ʽ �� C�й����ŵ���������
��3��D��E�Ļ�ѧ����ʽΪ��
��4��D�ж���ͬ���칹�壬���з�������������ͬ���칹�壨�����������칹�������֣�д�����к˴Ź���������5���Ľṹ��ʽ��
������Ũ��ˮ����ȡ����Ӧ�����ܷ���ˮ�ⷴӦ��
��5����C����ϩΪ����ԭ�ϣ�����ͼ3��ʾ�仯�ɵõ�һ����;�㷺���������ܼ�G��
���Լ�I����
�ڹ�ҵ�Ϸ���I���Լ�����������
��������G�ķ�Ӧ�У����ĵ���H��F���ʵ���֮��Ϊ1��2����G�ķ���ʽΪ ��
���𰸡�
��1���ڶ��ױ���1��2�����ױ���4
��2��![]() ��ȩ��
��ȩ��
��3��![]()
��4��19��![]()
��5��ˮ�������������ͼ��ȣ�C12H14O4
���������⣺A�DZ���ͬϵ�1molA��1mol���ֱ���ȫȼ��ʱ��A�ȱ�������3molO2 �� ˵��A�ȱ��ੁCH2CH2ԭ���ţ�A�ĺ˴Ź���������3��壬��AΪ 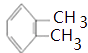 ��A�������ڹ��������·���ȡ����Ӧ����B��X��B��X��Ϊͬ���칹�壬1molC����������Ӧʱ���ɵõ�4molAg��˵��һ��C�����к�������ȩ����B����ˮ�ⷴӦ����C����BΪ
��A�������ڹ��������·���ȡ����Ӧ����B��X��B��X��Ϊͬ���칹�壬1molC����������Ӧʱ���ɵõ�4molAg��˵��һ��C�����к�������ȩ����B����ˮ�ⷴӦ����C����BΪ ![]() ��CΪ
��CΪ  ��X��B��ͬ���칹�壬��XΪ
��X��B��ͬ���칹�壬��XΪ ![]() ��X����ˮ�ⷴӦȻ���ữ�õ�D��DΪ
��X����ˮ�ⷴӦȻ���ữ�õ�D��DΪ ![]() ��D�������۷�Ӧ���ɸ߷��ӻ����������Ϊ
��D�������۷�Ӧ���ɸ߷��ӻ����������Ϊ 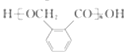 ����5��G���������ܼ���Ӧ���Ǹ߷�����������H��F����������Ӧ����G��H��Fһ�������ᡢһ���Ǵ�����ϩ��ˮ��Ӧ�����Ҵ���������G�ķ�Ӧ�У����ĵ���H��F���ʵ���֮��Ϊ1��2����HΪ���ᣬ����HΪ
����5��G���������ܼ���Ӧ���Ǹ߷�����������H��F����������Ӧ����G��H��Fһ�������ᡢһ���Ǵ�����ϩ��ˮ��Ӧ�����Ҵ���������G�ķ�Ӧ�У����ĵ���H��F���ʵ���֮��Ϊ1��2����HΪ���ᣬ����HΪ ![]() ��FΪCH3CH2OH��GΪ
��FΪCH3CH2OH��GΪ ![]() ����1��AΪ
����1��AΪ 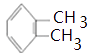 ��A���������ڶ��ױ���1��2�����ױ���BΪ
��A���������ڶ��ױ���1��2�����ױ���BΪ ![]() ��Bˮ�����ɵ�HCl���������Ʒ�Ӧ������1molB�������4molNaOH�����Դ��ǣ��ڶ��ױ���1��2�����ױ���4����2��X�Ľṹ��ʽΪ
��Bˮ�����ɵ�HCl���������Ʒ�Ӧ������1molB�������4molNaOH�����Դ��ǣ��ڶ��ױ���1��2�����ױ���4����2��X�Ľṹ��ʽΪ ![]() ��C�й����ŵ�������ȩ�������Դ��ǣ�
��C�й����ŵ�������ȩ�������Դ��ǣ� ![]() ��ȩ������3��D�������۷�Ӧ����E���÷�Ӧ�Ļ�ѧ����ʽΪ
��ȩ������3��D�������۷�Ӧ����E���÷�Ӧ�Ļ�ѧ����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����4��DΪ
����4��DΪ ![]() ��D��ͬ���칹���������������������Ũ��ˮ����ȡ����Ӧ˵�����з��ǻ������ܷ���ˮ�ⷴӦ˵������������
��D��ͬ���칹���������������������Ũ��ˮ����ȡ����Ӧ˵�����з��ǻ������ܷ���ˮ�ⷴӦ˵������������
������������ͷ��ǻ���Ϊ���з��ǻ��ı�������������ڼ�����ֽṹ��
���Ϊ���з��ǻ��ļ��ᱽ���������ڼ��3�ֽṹ��
���Ϊ���з��ǻ������ᱽ�������ڼ��3�ֽṹ��
������Щ�OH�������ͼ���
��������ͩ�OH������λ����4�ֽṹ��
��������ͩ�OHλ�ڼ�λ����4�ֽṹ��
��������ͩ�OHλ�ڶ�λ����2�ֽ�ϣ�
���Է�����������19�ֽṹ��
���к˴Ź���������5���Ľṹ��ʽΪ ![]() �����Դ��ǣ�19��
�����Դ��ǣ�19�� ![]() ����5��G���������ܼ���Ӧ���Ǹ߷�����������H��F����������Ӧ����G��H��Fһ�������ᡢһ���Ǵ�����ϩ��ˮ��Ӧ�����Ҵ���������G�ķ�Ӧ�У����ĵ���H��F���ʵ���֮��Ϊ1��2����HΪ���ᣬ����HΪ
����5��G���������ܼ���Ӧ���Ǹ߷�����������H��F����������Ӧ����G��H��Fһ�������ᡢһ���Ǵ�����ϩ��ˮ��Ӧ�����Ҵ���������G�ķ�Ӧ�У����ĵ���H��F���ʵ���֮��Ϊ1��2����HΪ���ᣬ����HΪ ![]() ��FΪCH3CH2OH��GΪ
��FΪCH3CH2OH��GΪ ![]() �����Լ�I��ˮ�����Դ��ǣ�ˮ��
�����Լ�I��ˮ�����Դ��ǣ�ˮ��
�ڹ�ҵ�Ϸ���I�ķ�Ӧ��ȩ�������������Ȼ������Ը÷�Ӧ���Լ��������������������ͼ��ȣ����Դ��ǣ������������ͼ��ȣ���GΪ ![]() ����G�ķ���ʽΪC12H14O4 �� ���Դ��ǣ�C12H14O4 ��
����G�ķ���ʽΪC12H14O4 �� ���Դ��ǣ�C12H14O4 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��ش������й����⣺
�� ���� | IA | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | �� | |
4 | �� |
(1)д������Ԫ�ط��ţ���_______��________��
(2)����ԭ�ӵĽṹʾ��ͼ����_________��________��
(3)�ڢ١�Ԫ���У���������ǿ��Ԫ����_________���ǽ�������ǿ��Ԫ����_______������õ�Ԫ����________ (����Ԫ�ط���)��
(4)Ԫ�آ���Ԫ�آ���ȣ��ǽ����Խ�ǿ����_______(��Ԫ�ط��ű�ʾ)�����б�������֤����һ��ʵ����___________(�����)��
a�������¢ߵĵ��ʺ͢�ĵ���״̬��ͬ
b������⻯��Ȣߵ��⻯���ȶ�
c��һ�������¢ߺ͢�ĵ��ʶ���������������Һ��Ӧ
(5)Ԫ�آ��ǹ��ɵؿǵ���ҪԪ��֮һ�������������ִ���ѧ��������Ʒ�Ļ���ԭ�ϣ���������Ļ�ѧʽΪ_____���Ҹ���������ܽ���ǿ��NaOH�������ӷ���ʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶��£���1mol A��2mol B����һ�ܱ������У�������Ӧ��aA��g��+B��g��C��g��+D��g����һ��ʱ����ƽ�⣬��֪�����ʵ�ƽ��Ũ�ȵĹ�ϵΪca��A��c��B��=c��C��c��D�������¶Ȳ��䣬�������������СΪԭ���� ![]() ��A ��ת����û�з����仯����B��ת����Ϊ�� ��
��A ��ת����û�з����仯����B��ת����Ϊ�� ��
A.60%
B.40%
C.33.3%
D.66.7%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش��������⣺
���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� | �� |
��1������ЩԪ���У���������ǿ��Ԫ����_____������õķǽ���Ԫ����_______________
��2����ѧ��������õ�Ԫ����______________����ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ___________��
��3��Ԫ�ص�����������Ӧ��ˮ������������ǿ����______________��������ǿ����____________��
��4���ڢۡ���Ԫ���У�ԭ�Ӱ뾶������________��ԭ�Ӱ뾶��С����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ӵ�������һ��ˮ���ӵ�������һ��ˮ���ӵ����������ȷ������������
A. 1Ħ��ˮ������B. 1Ħ��ˮ����������
C. 1Ħ��ˮ�����D. 1Ħ��ˮ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£���������Ĵ�Сȡ���ڣ� ��
A. ���Ӱ뾶B. ��������
C. ��������D. ���Ӽ��ƽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��ģ���������Ƽ������NaCl��NH3��CO2��ˮ��Ϊԭ���Լ�ͼ1��ʾװ����ȡNaHCO3����Ӧ�Ļ�ѧ����ʽΪNH3��CO2��H2O��NaCl===NaHCO3����NH4Cl��Ȼ���ٽ�NaHCO3�Ƴ�Na2CO3��

��1��װ���ҵ�������______________________________________��Ϊ��ֹ��Ⱦ������β���к��е�______________��Ҫ�������մ�����
��2����װ�ñ��в�����NaHCO3��ȡNa2CO3ʱ����Ҫ���е�ʵ�������________________��ϴ�ӡ����ա�
��3������(2)�����յ�ʱ��϶̣�NaHCO3���ֽⲻ��ȫ����С���һ�ݼ�����t1min��NaHCO3��Ʒ����ɽ������о���ȡ������t1min��NaHCO3��Ʒ29.6 g��ȫ����ˮ�Ƴ���Һ��Ȼ�������Һ�л����صμ�ϡ���ᣬ�����Ͻ��裬��������ļ��룬��Һ���й����ӵ����ʵ����ı仯��ͼ2��ʾ��������c��Ӧ����Һ�е�������______________________(�����ӷ���)������Ʒ��NaHCO3��Na2CO3�����ʵ���֮����__________��
��4����ȡ10.5 g NaHCO3���壬������t1min��ʣ����������Ϊ7.4 g������Ѵ�ʣ�����ȫ�����뵽200 mL 1 mol��L��1�������У����ַ�Ӧ����Һ��H�������ʵ���Ũ��Ϊ__________(����Һ����仯���Բ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ������ͼ��ʾ��
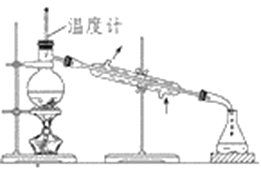
��1������ʵ������ɼ��Ϊ������������㣬��Ե��Ե����ƽ�������ɷ����У�������ˮ�����С�������������ˮ���������ĺ�����___________________________________��
��2��������ʵ���У�ʹ���¶ȼƵ�ԭ����________________________________________��
��3���¶ȼ�ˮ�����λ����________________________________________________��
��4����ȡ����ˮʱ���Բ�ʹ���¶ȼƵ�ԭ����______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ����С��Ϊ��̽��ͭ��ϡ���ᷴӦ��������NO���壬���������ʵ�顣ʵ��װ����ͼ��ʾ��

��1�����װ��A��Ŀ����_______________________________________________ ��A�з�Ӧ�Ļ�ѧ����ʽ��__________________________________________
��2������1���еIJ�����װ��B��ͭ˿����ϡ���ᣬ����֮���۲쵽װ��B�е�������_________________________________________��B�з�Ӧ�����ӷ���ʽ��________________________________________��
��3��װ��E��F��������_____________________________________��Ϊʵ�ִ�Ŀ�ģ�����������_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com