
在稀硫酸与锌反应制取氢气的实验中,探究加人硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0一4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336 mL,)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是
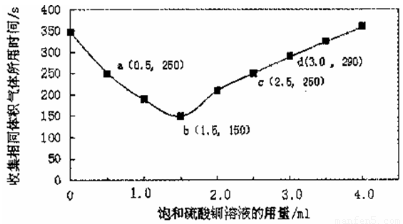
A.饱和硫酸铜溶液用量过多不利于更快收集氢气
B.a ,c两点对应的氢气生成速率相等
C.b点对应的反应速率为v( H2SO4)=1.0x10-3mol·L -1 ·s-1
D.d点没有构成原电池,反应速率减慢
D
【解析】
试题分析:A、根据图像可知随着饱和硫酸铜的增加,收集相同体积的气体所需时间先逐渐减少,然后又逐渐增加,因此饱和硫酸铜溶液用量过多不利于更快收集氢气,A正确;B、根据图像可知a ,c两点对应的时间都是250s,所以氢气生成速率相等,B正确;C、b点对应的时间是150s,生成氢气的物质的量是0.336L÷22.4L/mol=0.015mol,消耗稀硫酸的物质的量是0.015mol,其浓度是0.015mol÷0.1L=0.15mol/L,所以反应速率为v( H2SO4)=0.15mol/L÷150s=1.0x10-3mol·L -1 ·s-1,C正确;D、d点锌也与硫酸铜溶液反应生成铜从而构成原电池,D不正确,答案选D。
考点:考查反应速率影响因素的实验探究


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 实验 混合溶液 |
A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第18期 总第174期 人教课标版 题型:013
|
下列变化的实质相似的是 | |
| [ ] | |
A. |
浓硫酸和浓盐酸在空气中敞口放置时浓度均减小 |
B. |
SO2和Cl2均能使品红溶液褪色 |
C. |
浓硫酸和稀硫酸与锌反应时均产生气体 |
D. |
HBr、HI气体均不能用浓硫酸制取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com