
【题目】磷酸二氢钾(KH2PO4)是一种重要的化工产品,工业上常用作缓冲剂和培养剂,农业上常用作 复合肥料。以氟磷灰石[主要成分为Ca5F(PO4)3,还含有少量的Fe2O3、A12O3等杂质]为原料制备KH2PO4 晶体的一种流程如下:
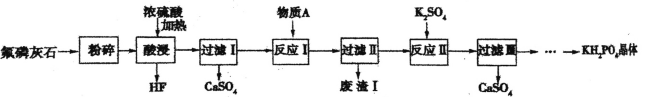
回答下列问题:
(1)“酸浸”过程中生成磷酸的化学方程式为________,若用盐酸代替硫酸,磷酸的产率会明显提高,原因是___,该过程所用的仪器不能釆用二氧化硅陶瓷材料,其主要原因是_____________(用化学方程式表示)。
(2)己知物质A为CaCO3,其作用是调节溶液pH,则“废渣I”的主要成分为__________。
(3) “反应II ”的化学方程式为 _______。
(4)将获得的KH2PO4晶体进行进一步提纯的方法名称为____。
(5)若用1000kg质量分数为50.4%的氟磷灰石来制取磷酸二氢钾晶体,其产率为80%,则生产出的磷酸二氢钾晶体的质量为 _____kg. 已知摩尔质量 M(Ca5F(PO4)3)=504g/mol,M(KH2PO4)=136 g/mol。
【答案】Ca5F(PO4)3+5H2SO4![]() 5CaSO4 ↓ +HF ↑ +3H3PO4 生成的硫酸钙会附着在磷灰石的表面,阻止反应进一步进行 SiO2+4HF═SiF4↑ +2H2O Fe(OH)3、Al(OH)3 K2SO4+Ca(H2PO4)2═2KH2PO4+CaSO4↓ 重结晶 326.4
5CaSO4 ↓ +HF ↑ +3H3PO4 生成的硫酸钙会附着在磷灰石的表面,阻止反应进一步进行 SiO2+4HF═SiF4↑ +2H2O Fe(OH)3、Al(OH)3 K2SO4+Ca(H2PO4)2═2KH2PO4+CaSO4↓ 重结晶 326.4
【解析】
氟磷灰石主要成分为Ca5F(PO4)3,还含有少量的Fe2O3、A12O3等杂质,将氟磷灰石经粉碎后加入浓硫酸,可得到HF气体,过滤得到硫酸钙晶体,滤液中含有磷酸和硫酸铁、硫酸铝,滤液中加入碳酸钙,调节溶液pH,使溶液中的Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀而过滤除去,滤液II中加入K2SO4,进一步除去溶液中的Ca2+,过滤除去CaSO4,将滤液蒸发浓缩、冷却结晶可得到KH2PO4,以此解答该题。
(1)“酸浸”过程中浓硫酸溶解Ca5F(PO4)3,生成磷酸的同时有硫酸钙、HF,则发生反应的化学方程式为Ca5F(PO4)3+5H2SO4![]() 5CaSO4 ↓ +HF ↑ +3H3PO4;因硫酸钙微溶于水,附着在磷灰石的表面,阻止反应进一步进行,因此用盐酸代替硫酸,可明显提高磷酸的产率;该过程生成的HF能腐蚀玻璃,发生反应的化学方程式为SiO2+4HF═SiF4↑ +2H2O,则所用的仪器不能釆用二氧化硅陶瓷材料;
5CaSO4 ↓ +HF ↑ +3H3PO4;因硫酸钙微溶于水,附着在磷灰石的表面,阻止反应进一步进行,因此用盐酸代替硫酸,可明显提高磷酸的产率;该过程生成的HF能腐蚀玻璃,发生反应的化学方程式为SiO2+4HF═SiF4↑ +2H2O,则所用的仪器不能釆用二氧化硅陶瓷材料;
(2)物质A为CaCO3,其作用是调节溶液pH,促进溶液中Fe3+、Al3+完全水解转化为Fe(OH)3、Al(OH)3沉淀,则过滤得到的“废渣I”的主要成分为Fe(OH)3、Al(OH)3;
(3) “反应II”是滤液中加入K2SO4,和Ca(H2PO4)2发生复分解反应生成KH2PO4和CaSO4,发生反应的化学方程式为K2SO4+Ca(H2PO4)2═2KH2PO4+CaSO4↓;
(4)将溶液中获得的KH2PO4晶体进一步提纯,可根据溶解度随温度的变化不同,选择重结晶操作;
(5)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,Ca5P3FO12反应的质量为1000kg×50.4%×80%=403.2kg,物质的量为![]() =800mol,则理论上可生产KH2PO4的质量为800mol×136g/mol×3=326400g=326.4kg。
=800mol,则理论上可生产KH2PO4的质量为800mol×136g/mol×3=326400g=326.4kg。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】G是合成某新型药物的中间体,下图是合成 G的部分流程:
已知:

乙酸酐的结构简式为![]()
请回答下列问题:
(1)G 中含氧官能团的名称是_______、________。
(2)反应 A→B 的化学方程式为________________。
(3)有机物 F的结构简式为_________________。
(4)反应 ④、⑤的反应类型分别是_________、___________。
(5)写出满足下列条件的 C 的同分异构体的结构简式______________________。
Ⅰ.苯环上只有两种取代基
Ⅱ.分子中只有 4 种不同化学环境的氢原子
Ⅲ.能与NaHCO3溶液反应生成 CO2
(6)以乙酸酐和![]() 为原料,制备
为原料,制备![]() 的部分流程图如下。请结合相关信息和已学知识,将合成路线补充完整(无机试剂任选)。
的部分流程图如下。请结合相关信息和已学知识,将合成路线补充完整(无机试剂任选)。
![]() ______________
______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为___________。
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:
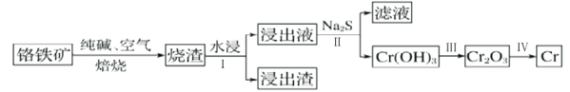
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②水浸Ⅰ要获得浸出液的操作是___________。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________。
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为___________[c(Cr3+)降至10-5mol·L-1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。
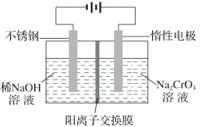
①阳极的电极反应式为___________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,如图中的曲线可近似表示整个过程中混合溶液的导电能力变化的是(用电流强度I表示)

A. 曲线AB. 曲线BC. 曲线CD. 曲线D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)![]() 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镧系为元素周期表中第ⅢB族、原子序数为5771的元素。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:____________.
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为____________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_____填元素名称)。
几种镧系元素的电离能(单位:kJmol-1)
元素 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
Yb (镱) | 604 | 1217 | 4494 | 5014 |
Lu (镥) | 532 | 1390 | 4111 | 4987 |
La (镧) | 538 | 1067 | 1850 | 5419 |
Ce (铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______(用元素符号表示)。
②画出氨的最简单气态氢化物水溶液中存在的氢键:________(任写一种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为_____,分子中所含化学键类型有 _______(填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有_____个氧原子;已知晶胞参数为apm,密度为ρgcm-3,NA=_______(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室利用铜和稀硝酸制备一氧化氮:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,该反应的离子方程式为___。每生成11.2LNO(标准状况),转移的电子数为___NA。
Ⅱ.(1)在发射“神舟”十一号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知:
N2H4(l)+2H2O2(l)==N2(g)+4H2O(g) ΔH1;
H2O(l)==H2O(g) ΔH2
请写出液态肼与足量过氧化氢反应生成氮气和液态水的热化学方程式:_____。
(2)在25℃,101kPa下,1molCO完全燃烧放出283.0kJ的热量。请写出表示CO燃烧热的热化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为Fe2O3和CuO的混合物且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
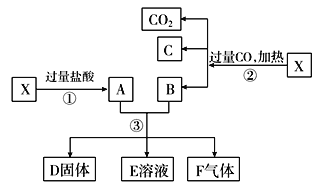
(1)写出步骤③可能发生反应的离子方程式:________________________(共有3个,任写一个即可)。
(2)若溶液E中只有一种金属离子,则一定是__________;若溶液E中含有两种金属离子,则一定是________。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(![]() )中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A. 电解质溶液中混入水,对电池反应无影响
B. 金属锂作电池的正极,石墨作电池的负极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D. 电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com