
����Ŀ����һ��﮵�أ��ý���﮺�ʯī���缫���ϣ��������Һ����������ﮣ�LiAlCl4���ܽ����������ȣ�![]() ���ж��γɵģ�����ܷ�Ӧ����ʽΪ��8Li��3SOCl2===6LiCl��Li2SO3��2S��������������ȷ���ǣ� ��
���ж��γɵģ�����ܷ�Ӧ����ʽΪ��8Li��3SOCl2===6LiCl��Li2SO3��2S��������������ȷ���ǣ� ��
A. �������Һ�л���ˮ���Ե�ط�Ӧ��Ӱ��
B. ���������ص�������ʯī����صĸ���
C. ��ع��������У��������ȣ�SOCl2������ԭΪLi2SO3
D. ��ع��������У�������ṩ�ĵ�����������������������ʵ���֮��Ϊ4��1
���𰸡�D
�����������������A��Li���ڼ��������ѧ���ʽϻ��ã����������Һ�л���ˮ����Li��ˮ��Ӧ����������﮺�������Ӱ���ط�Ӧ��A����B��LiԪ�صĻ��ϼ����ߵ�+1�ۣ�����Li����������Ӧ������صĸ�����B����C����ع��������У�SԪ�صĻ��ϼ۴�+4�۽��͵�0�ۣ������������ȱ���ԭΪS���ʣ�C����D����ع��������У���8molLi�μӷ�Ӧ����ʧȥ���ӵ����ʵ�����8mol������2molS���ʣ����Խ�����ṩ�ĵ���������������������ʵ���֮��Ϊ8:2=4:l��D��ȷ����ѡD��


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(KH2PO4)��һ����Ҫ�Ļ�����Ʒ����ҵ�ϳ��������������������ũҵ�ϳ����� ���Ϸ��ϡ��Է���ʯ����Ҫ�ɷ�ΪCa5F(PO4)3,������������Fe2O3��A12O3�����ʣ�Ϊԭ���Ʊ�KH2PO4 �����һ���������£�
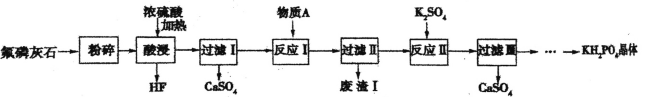
�ش��������⣺
(1)���������������������Ļ�ѧ����ʽΪ________����������������ᣬ����IJ��ʻ�������ߣ�ԭ����___���ù������õ�����������ö��������մɲ��ϣ�����Ҫԭ����_____________(�û�ѧ����ʽ��ʾ)��
(2)��֪����AΪCaCO3,�������ǵ�����ҺpH,��������I������Ҫ�ɷ�Ϊ__________��
(3) ����ӦII ���Ļ�ѧ����ʽΪ _______��
(4)����õ�KH2PO4������н�һ���ᴿ�ķ�������Ϊ____��
(5)����1000kg��������Ϊ50.4%�ķ���ʯ����ȡ�������ؾ��壬�����Ϊ80%,�����������������ؾ��������Ϊ _____kg. ��֪Ħ������ M��Ca5F(PO4)3��=504g/mol,M(KH2PO4)=136 g/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100 mL 0.01 mol��L-1HA��Һ����μ���0.02 mol��L-1��MOH��Һ��������ʾ���߱�ʾ�����Һ��pH�仯���������˵������ȷ���ǣ� ��
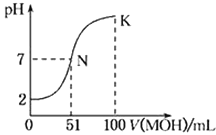
A.HAΪһԪ���ᣬMOHΪһԪǿ��
B.����MOH��Һ�����Ϊ50 mLʱ��c(M+)��c(A-)
C.N��ˮ�ĵ���̶ȴ���K��ˮ�ĵ���̶�
D.K��ʱ��c��MOH��+ c��M+��=0.02 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ̶��ݻ����ܱ������У�A��B�������з�Ӧ��A��s��+2B��g��![]() 2C��g����H��0����һ�������´ﵽƽ�⣬�������¶����ƽ����������
2C��g����H��0����һ�������´ﵽƽ�⣬�������¶����ƽ����������
A��ƽ����Է����������� B��ƽ����Է���������С C���ܶȼ�С D�� ����ѹǿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2molA��2molB�����2L���ܱ������У��������·�Ӧ��2A(g)+3B(g) ![]() 2C(g)+2D(g),2s��A��ת����Ϊ50%�����v(D)=0.25mol/(L��s)�������ƶϲ���ȷ����
2C(g)+2D(g),2s��A��ת����Ϊ50%�����v(D)=0.25mol/(L��s)�������ƶϲ���ȷ����
A. z=2
B. 2s�������ڵ�ѹǿ�dz�ʼ��7/8��
C. 2sʱ,C���������Ϊ2/7
D. 2s��B��Ũ��Ϊ0.5mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ��1L���ܱ������У�����2molA��1molB�������·�Ӧ��2A(g)+2B(g)![]() 3C(?)+D(?)����Ӧһ��ʱ���ﵽƽ�⣬�������0.6molC���ҷ�Ӧǰ��ѹǿ֮��Ϊ15��11(��ͬ�¶��²���)��������˵����ȷ���ǣ� ��
3C(?)+D(?)����Ӧһ��ʱ���ﵽƽ�⣬�������0.6molC���ҷ�Ӧǰ��ѹǿ֮��Ϊ15��11(��ͬ�¶��²���)��������˵����ȷ���ǣ� ��
A. �÷�Ӧ�Ļ�ѧƽ�ⳣ��KԼΪ0.043
B. ����C�����ʵ�����B��ƽ��ת���ʲ���
C. �������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������
D. A��ƽ��ת������40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����( )
A.�������������������Һ�У� SiO2+4H++4F-=SiF4�� +2H2O
B.ƫ��������Һ��ͨ�������CO2��2AlO2- + CO2+3H2O=2Al(OH)3��+ CO32-
C.ϡ�����������������Һ�У�H+ +![]() + Ba2+ + OH-=BaSO4��+ H2O
+ Ba2+ + OH-=BaSO4��+ H2O
D.��������Һ�м�������İ�ˮ��Al3++3NH3��H2O=Al(OH)3��+3NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 mol��L-1 H2SO4���� 480mL 1mol��L-1 H2SO4�������¼���������
�ټ��㲢����Ͳ��ȡ x mL10 mol��L-1 H2SO4��ϡ�ͣ�
�ڽ�ϡ�ͺ����Һת����Ϊ y ������ƿ�У�
������������ˮϴ���ձ��Ͳ�����2�C3�Σ���ת������ƿ��
�ܼ���������ƿ�м�����ˮ���̶��ߣ�
�ݽ�����ƿ���������ҡ�ȡ�
(1)����д���������� x��y�ֱ��ǣ�x________________��y________________��
(2)��û�н��в����ۣ���������Һ��Ũ��________________ (�ƫ�ߡ�����ƫ�͡���Ӱ�족����ͬ)���������ж���ʱ���ӿ̶��ߣ���������Һ��Ũ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ʊ��治�����ױ��ʡ�ij����С��Ϊ�˴��Բⶨ�������Ƶ��������������dz�ȡ2.0g��Ʒ�����������ͼװ�����ⶨ�������Ƶ�����������ͼ�е�E��F��������װ�ã������ⶨO2�������
| |||||
A | B | C | D | E | F |
(1)д��װ��A��������Ҫ��������������__________��_______��
(2)д��װ��A�з��������ӷ���ʽ____________________________��
(3)װ��B��������______________________________��
(4)д��װ��C�з�����Ӧ����Ҫ��ѧ����ʽ��______________________________��
(5)װ��D�� NaOH��������________________________________________��
(6)�����ڶ�����Ͳ��ˮ�������������ɱ�״�������������Ϊ224mL������Ʒ�й������Ƶ���������Ϊ__________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com