
【题目】将一定量Na2CO3、NaHCO3组成的混合物溶于水配成50 mL溶液,逐滴加入稀盐酸,得到各成分物质的量变化如图所示(忽略溶液混合导致的体积变化,已知1 mol=1000 mmol)。
下列说法不正确的是
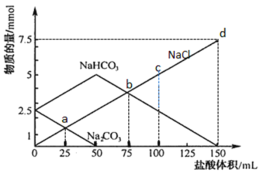
A.盐酸的物质的量浓度为0.05 mol·L-1
B.c点溶液中c(NaCl)=0.05 mol·L-1
C.a点溶液中发生反应的离子方程式为:CO![]() + H+ = HCO
+ H+ = HCO![]()
D.b点和d点所处的溶液中n(Na+)相等
【答案】B
【解析】
Na2CO3和HCl的反应分为两步:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O;加入50mL盐酸时,Na2CO3的物质的量由2.5mmol降为0,此时溶液中的溶质为NaHCO3和NaCl,之后加入到150mL盐酸时,NaHCO3的物质的量由5mmol降为0,此时溶液中的溶质为NaCl。
A.0~50mL发生反应Na2CO3+HCl=NaHCO3+NaCl,n(Na2CO3)=0.0025mol,根据反应方程式可知50mL盐酸中n(HCl)=0.0025mol,所以c(HCl)=![]() =0.05mol/L,故A正确;
=0.05mol/L,故A正确;
B.c点加入100mL盐酸,根据元素守恒n(NaCl)= n(HCl)=0.1L×0.05mol/L=0.005mol,此时溶液的体积为50mL+100mL=150mL,所以c(NaCl)=![]() ,故B错误;
,故B错误;
C.据图可知a点Na2CO3还有剩余,所以发生的离子反应为CO![]() +H+ =HCO
+H+ =HCO![]() ,故C正确;
,故C正确;
D.混合溶液中滴加的是HCl,所以溶液中n(Na+)始终不变,b点和d点所处的溶液中n(Na+)相等,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】甲烷、乙烯、乙醇都是重要的有机化合物。请回答下列问题:
(1)甲烷与氯气的第一步取代反应的化学方程式为____。
(2)把乙烯通入到溴的四氯化碳溶液中,充分振荡、静置,观察到溴的四氯化碳溶液褪色,写出该过程中发生反应的化学方程式___。
(3)下列几组物质中,互为同分异构体的是___,互为同位素的是___,互为同素异形体的是______,属于同一种物质的是__。
A.甲烷与新戊烷 B.氧气和臭氧 C.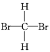 和
和![]() D.35Cl和37Cl E.CH3CH2OH和CH3OCH3
D.35Cl和37Cl E.CH3CH2OH和CH3OCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
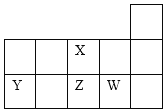
A.Y、Z、X三种元素的原子半径依次增大
B.X、Z都是第二周期ⅥA族元素,单质的氧化性X>Z
C.Y的气态氢化物的热稳定性比Z的高
D.W元素最高价氧化物的水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:链烃A(C5H8)有支链且只有一个官能团。有机化合物A→H、A→F的转换关系如下所示:
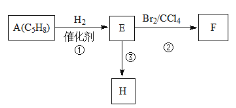
(1)A的结构简式是____________,名称是_______________。
(2)链烃B是A的不同类别的同分异构体,B经催化氢化转化为正戊烷,写出B的结构简式_____________________。(写一个)
(3)已知,H是高分子化合物,写出E→H反应的方程式________________________________________。
(4)写出反应类型:反应②_________________________,反应③_________________________。
(5)设计一条由电石制取聚氯乙烯的合成路线(其他试剂自选)。_____________________________(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:

已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有___(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:___。
(2)滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为___(填字母)。
a.加入过量的氨水
b.通入过量的CO2
c.加入过量的NaOH
d.加入适量的HCl
e.洗涤
f.过滤
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:___。
②若用浓HNO3溶解金属硫化物,缺点是___(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于___。
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。
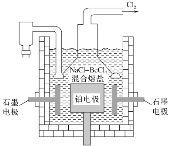
①石墨电极上的电极反应式为___。
②电解得到的Be蒸气中约含1%的Na蒸气,除去Be中少量Na的方法为___。
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子结构中,各种化学键如下图所示:关于乙醇在各种反应中断裂键的说明正确的是( )

A. 和乙酸、浓H2SO4共热时断裂键②
B. 和金属钠反应时断裂键⑤
C. 和浓H2SO4共热至170℃时断裂②、⑤键
D. 在Cu催化下和O2反应时断裂①、⑤键
查看答案和解析>>
科目:高中化学 来源: 题型:
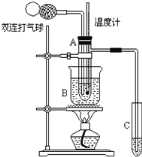
【题目】乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体),已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)_____________________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置:
①在实验开始时温度计水银球的位置应在_____________________;
②当试管A内的主要反应完成后温度计水银球的位置应在_______________,目的是________________________________________________;
(3)烧杯B内盛装的液体可以是________(写出一种即可);在实验的不同阶段,烧杯B的作用分别是_________________、______________________;
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气系统中的催化转化器,可有效降低尾气中的CO、NO和NO2等向大气的排放。在催化转化器的前半部发生的反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是
2CO2(g)+N2(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零B. CO、NO、CO2、N2的浓度相等
C. CO、NO、CO2、N2在容器中共存D. CO、NO、CO2、N2的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题,
(1)请写出基态Cu原子的外围电子排布式 ____________ 。焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了 _________ 而变为激发态。
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式

请分析1个松脂酸铜中π键的个数_____ ;加 “*”碳原子的杂化方式为 ______ 。
(3)下图是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号)______________ ;与X等距离且最近的X原子个数为____

(4)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型______,比较第一电离能:S _____ O(填“>”或“<”)
(5)黄铜合金可以表示为Cu3Zn,为面心立方晶胞,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果)____________ nm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com