
【题目】用98%的浓硫酸(密度为1.84gcm﹣3)配制1molL﹣1的稀硫酸100mL.配制过程中可能用到下列仪器:①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.按使用先后顺序排列正确的是( )
A.④③⑦⑤⑥
B.②⑤⑦④⑥
C.④③⑤⑥⑦
D.②⑥③⑦⑤⑥
【答案】D
【解析】解:98%的浓H2SO4的物质的量浓度为c= ![]() =
= ![]() =18.4mol/L,配制1molL﹣1的稀H2SO4 100mL需要浓硫酸的体积为V=
=18.4mol/L,配制1molL﹣1的稀H2SO4 100mL需要浓硫酸的体积为V= ![]() =0.0054L,即5.4ml,应选择10ml量筒,实验时用10ml量筒量取5.4ml浓硫酸,而配制一定物质的量浓度的溶液需要量取、稀释、转移、洗涤、定容、摇匀等操作,量取浓硫酸时需要用到10mL量筒和胶头滴管,稀释浓硫酸时需要用到烧杯和玻璃棒,转移溶液时需要用到玻璃棒,定容时需要用到100mL容量瓶和胶头滴管,所以正确顺序为②⑥③⑦⑤⑥. 故选:D.
=0.0054L,即5.4ml,应选择10ml量筒,实验时用10ml量筒量取5.4ml浓硫酸,而配制一定物质的量浓度的溶液需要量取、稀释、转移、洗涤、定容、摇匀等操作,量取浓硫酸时需要用到10mL量筒和胶头滴管,稀释浓硫酸时需要用到烧杯和玻璃棒,转移溶液时需要用到玻璃棒,定容时需要用到100mL容量瓶和胶头滴管,所以正确顺序为②⑥③⑦⑤⑥. 故选:D.
先根据稀释前后溶质的物质的量不变,计算出浓溶液的体积,选取合适的量筒,再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等操作解答.


科目:高中化学 来源: 题型:
【题目】现有失去标签的CaCl2、AgNO3、HCl、和Na2CO3四瓶溶液.为了确定四种溶液的成分,将它们编号为A、B、C、D后进行化学实验.实验记录如下:
实验顺序 | 实验内容 | 实验现象 |
① | A+B | 无明显现象 |
② | B+D | 有无色无味气体放出 |
③ | C+B | 有白色沉淀生成 |
④ | A+D | 有白色沉淀生成 |
根据上述实验完成下列各小题:
(1)A、B、C、D四瓶溶液分别是(用化学式表示所含溶质)ABCD
(2)写出B与D反应的离子方程式写出B与C反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质及用途对应不正确的是
A | B | C | D | |
物质名称 | 氯气 | 小苏打 | 二氧化硅 | 氧化铁 |
用途 | 制漂白粉 | 治疗胃酸过多 | 制半导体材料 | 用作红色涂料 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某酸性溶液(可能含有Br﹣ , SO42﹣ , H2SO3 , NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸.
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br﹣
B.SO42﹣
C.H2SO3
D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.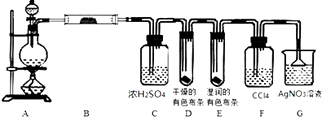
(1)用MnO2和浓盐酸混合共热制得氯气的化学方程式是;
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2 , 制得的Cl2体积在标准状况下总是小于1.12L的原因是;
(3)①装置B的作用是;②装置D和E出现的不同现象说明的问题是;
③装置F的作用是;
④装置G中发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们使用的涂改液中含有很多有害的挥发性物质,二氯甲烷就是其中一种,吸入会引起慢性中毒,有关二氯甲烷的说法正确的是( )
A.含有非极性键的极性分子
B.含有极性键的极性分子
C.有两种同分异构体
D.含有极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,相同质量的铝片分别与足量的盐酸和氢氧化钠溶液反应,下列说法正确的是( )
A. 盐酸产生气体的体积大
B. 盐酸产生气体的体积小
C. 产生气体的体积相等
D. 消耗氢氧化钠的物质的量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫.
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料.请写出焦炭与水蒸气高温下反应的化学方程式: .
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体.
已知:①2CO(g)+O2(g)═2CO2(g)△H1=﹣566kJmol﹣1
②2NO(g)+2CO(g)N2(g)+2CO2(g)△H2=﹣746kJmol﹣1
则反应N2(g)+O2(g)═2NO(g)的△H=kJmol﹣1 .
(3)在一定温度下,向1L密闭容器中充入0.5mol NO、2mol CO,发生上述反应②,20s反应达平衡,此时CO的物质的量为1.6mol.在该温度下反应的平衡常数K= .
(4)NO2会污染环境,可用NaOH溶液吸收NO2并生成等量的NaNO3和NaNO2 . 此反应的离子方程式是;恰好反应后,所得溶液呈弱碱性,则溶液中离子浓度大小关系是 c(Na+)> .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生巨大能量,可作为航天运载火箭的推动力。下列叙述中正确的是
A.偏二甲肼的摩尔质量为60 g B.6.02×1023个偏二甲肼分子的质量为60 g
C.1 mol偏二甲肼的质量为60 g/mol D.6 g偏二甲肼含有NA个偏二甲肼分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com