
【题目】现有失去标签的CaCl2、AgNO3、HCl、和Na2CO3四瓶溶液.为了确定四种溶液的成分,将它们编号为A、B、C、D后进行化学实验.实验记录如下:
实验顺序 | 实验内容 | 实验现象 |
① | A+B | 无明显现象 |
② | B+D | 有无色无味气体放出 |
③ | C+B | 有白色沉淀生成 |
④ | A+D | 有白色沉淀生成 |
根据上述实验完成下列各小题:
(1)A、B、C、D四瓶溶液分别是(用化学式表示所含溶质)ABCD
(2)写出B与D反应的离子方程式写出B与C反应的离子方程式 .
【答案】
(1)CaCl2;HCl;AgNO3;Na2CO3
(2)CO ![]() +2H+=CO2↑+H2O;Ag++Cl﹣=AgCl↓
+2H+=CO2↑+H2O;Ag++Cl﹣=AgCl↓
【解析】解:根据实验现象,A+B反应无明显现象,可确定A和B为CaCl2和HCl,再结合B+D反应有无色无味气体放出,反应的离子方程式为CO ![]() +2H+=CO2↑+H2O,可推出B为HCl,D为Na2CO3 , C+B反应有白色沉淀生成,可推出C为AgNO3 , 反应的离子方程式为Ag++Cl﹣=AgCl↓,最后根据A+D反应有白色沉淀生成,推出A为CaCl2 . (1)由以上分析可知A为CaCl2 , B为HCl,C为AgNO3 , D为Na2CO3 , 所以答案是:CaCl2;HCl;AgNO3;Na2CO3;(2)B为HCl,D为Na2CO3 , 反应有无色无味气体放出,反应的离子方程式为CO
+2H+=CO2↑+H2O,可推出B为HCl,D为Na2CO3 , C+B反应有白色沉淀生成,可推出C为AgNO3 , 反应的离子方程式为Ag++Cl﹣=AgCl↓,最后根据A+D反应有白色沉淀生成,推出A为CaCl2 . (1)由以上分析可知A为CaCl2 , B为HCl,C为AgNO3 , D为Na2CO3 , 所以答案是:CaCl2;HCl;AgNO3;Na2CO3;(2)B为HCl,D为Na2CO3 , 反应有无色无味气体放出,反应的离子方程式为CO ![]() +2H+=CO2↑+H2O, B为HCl,C为AgNO3 , 反应的离子方程式为Ag++Cl﹣=AgCl↓,所以答案是:CO32﹣+2H+=CO2↑+H2O;Ag++Cl﹣=AgCl↓.
+2H+=CO2↑+H2O, B为HCl,C为AgNO3 , 反应的离子方程式为Ag++Cl﹣=AgCl↓,所以答案是:CO32﹣+2H+=CO2↑+H2O;Ag++Cl﹣=AgCl↓.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于某些氧化物的说法正确的是( )
A. NO2、Na2O2都能与水发生氧化还原反应
B. NO、CO2均可用向上排空气法收集
C. CO2、SO2可用澄清石灰水鉴别
D. CO2、SO3都可由相应单质在O2中燃烧生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫铁矿焙烧的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
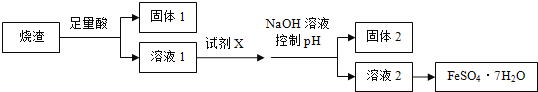
已知部分阳离子以氢氧化物形式沉淀时溶液的pH 见下表:
沉淀物 | F e(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)试剂X应选用________________。
(2)控制pH 的范用_________________。
(3)从溶液2得到FeSO4·7H2O 产品的过程中,须控制条作防止其氧化和分解,检验FeSO4溶液是否变质的方法是______________。
(4) 利用溶液1还可制备一种新型高效净水剂——聚合硫酸铝铁[Al2Feb(OH)m(SO4)n·xH2O],为了测定某种聚合硫酸铝铁的组成,进行如下实验:
步骤一:准确称取8.810g 样品溶于150mL0.100mol·L-1稀硫酸,恰如完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体10.485g;
步骤二:另取相同质量的样品,溶于过量的氢碘酸,充分搅拌反应后,以0.500mol·L-1 Na2S2O3溶液滴定至浅黄色,滴入几滴淀粉溶液,继续滴定至终点,消耗Na2S2O3溶液20.00mL。
(已知:I2+2Na2S2O3=2NaI+Na2S4O6 )
通过计算确定该聚合硫酸铝铁的化学式______________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示.下列说法错误的是( ) 
A.可利用KSCN溶液检验FeSO4溶液是否变质
B.沉淀过程中有CO2气体放出
C.过滤搡作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D.产品FeCO3在空气中高温分解可得到纯净的FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
Ⅰ.以氨为原料,合成尿素的反应原理为:
2NH3(g)+CO2(g)═CO(NH2)2(l)+H2O(g)△H=a kJ/mol.
为研究平衡时CO2的转化率与反应物投料比( ![]() )及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,并绘出如图(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系).
)及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,并绘出如图(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系).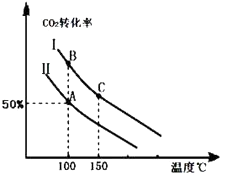
(1)a0 (填“>”或“<”),判断依据是 .
(2)①投料比:Ⅱ(填“>”或“<”).
②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.4,在100℃条件下发生反应,达平衡至A点,则A点与起始压强比为 .
③A点平衡常数与B点平衡常数间的关系:KAKB(填“>”或“<”或“=”).B点正反应速率与C点正反应速率间的关系为:v(B)v(C)(填“>”或“<”或“=”).
(3)若按曲线Ⅰ的投料比投料,在上述实验中压缩容器体积至5L,在图中画出反应达平衡时的二氧化碳的转化率与温度之间的关系曲线.
(4)为提高CO2转化率可以采取的措施是 .
a.使用催化剂 b.及时从体系中分离出部分CO(NH2)2c.将体系中的水蒸气液化分离
氨气可用于工业上生产硝酸,其尾气中的NO2可用氨水吸收生成硝酸铵,25℃时,将10molNH4NO3溶于水,溶液显酸性,向该溶液中滴加1L某浓度的氨水,溶液呈中性,则滴加氨水的过程中水的电离平衡将(填“正向”、“逆向”或“不”) 移动,此中性溶液中NH3H2O的物质的量为mol.(25℃时,NH3H2O的电离平衡常数Kb=2×10﹣5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2+2H2O 试回答下列问题:
Cl2↑+MnCl2+2H2O 试回答下列问题:
(1)实验室中可采用溶液来吸收有毒的氯气,写出该反应的离子方程式 .
(2)实验取质量分数为36.5%,密度为1.19gcm﹣3 , 浓盐酸100mL,反应结束后测得盐酸的浓度变为1.9mol/L,(忽略体积的变化)请你计算出实验过程生成标况下的Cl2多少L(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中能表示将Ba(OH)2溶液逐滴加入到硫酸铝溶液中,产生沉淀的质量(W)与加入Ba(OH)2溶液的体积(V)关系的是( )
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示. 
请回答下列问题:
(1)电极X的材料是;电解质溶液Y是;
(2)银电极为电池的极,发生的电极反应为;X电极上发生的电极反应为;
(3)外电路中的电子是从电极流向电极.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84gcm﹣3)配制1molL﹣1的稀硫酸100mL.配制过程中可能用到下列仪器:①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.按使用先后顺序排列正确的是( )
A.④③⑦⑤⑥
B.②⑤⑦④⑥
C.④③⑤⑥⑦
D.②⑥③⑦⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com