
【题目】NA表示阿伏伽德罗常数.下列说法正确的是( )
A.18gNH ![]() 含有质子的数目为10NA
含有质子的数目为10NA
B.1molNa2O2与足量CO2反应时,转移电子的数目为2NA
C.标准状况下,体积均为22.4L的O2、HCl、H2O含有的分子数目均为NA
D.质量为16g的O2和O3的混合气体中所含氧原子的数目为NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用括号内的试剂和方法除去下列各种物质中的少量杂质,可行的是
A.乙酸乙酯中的乙酸(NaOH溶液,分液)
B.乙醇中的乙酸(浓硫酸并加热)
C.苯中的溴(NaOH溶液,分液)
D.苯中的苯酚(溴水,过滤)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是科学与技术发展的基础。
①合金有许多特点。下列物质中,不属于合金的是________(填字母)。
a. 硬铝 b. 水银 c. 钢铁
②纳米陶瓷成功地解决了陶瓷易碎的问题。纳米陶瓷属于________(填字母)。
a. 无机非金属材料 b. 金属材料 c. 高分子材料
③“神九”国产“飞天”舱外服由六层组成。从内到外依次为由特殊防静电处理过的棉布组成的舒适层、合成橡胶质地的备份气密层、复合材料结构组成的主气密层、涤纶面料的限制层、隔热层和最外防护层。其中由天然有机高分子材料组成的层是_______(填字母)。
a. 舒适层 b. 备份气密层 c. 主气密层
④生产玻璃时,纯碱与石英反应的化学方程式为_________________。氮化硅陶瓷是一种高温结构陶瓷,可用于制造汽车发动机,氮化硅陶瓷的化学式为______。
(2)合理使用药物,保持营养均衡是保证身心健康、提高生活质量的有效手段。
①从中草药中提取的某生物碱,可用于治疗支气管哮喘、鼻黏膜充血引起的鼻塞等。此药物可能是________(填字母)。
a.阿司匹林 b.麻黄碱 c.胃舒平
②饮食不当会引起胃痛。胃舒平[主要成分是Al(OH)3]可治疗胃酸过多,写出Al(OH)3与胃酸反应的离子方程式________。
③维生素C是一种水溶性维生素。请从提供的药品中选出合适的试剂,写出检验维生素C溶液具有还原性的实验方法和现象:_________________________________(可选药品:石蕊试液、FeCl3溶液、KSCN溶液、淀粉溶液)。
(3)资源节约和环境友好,已成为社会和谐发展的主题。
①以煤炭为主的能源结构易导致酸雨的形成,形成这类酸雨的主要物质是________。燃煤排放的烟气中还含有其他污染物,请列举一种:________。
②居室装修所使用的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质名称是________。
③水中的重金属污染物可通过水中食物链被富集,也可在微生物作用下转化为毒性更大的有机化合物,如:HgCl2+CH4===CH3HgCl+________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式能表示可燃物燃烧热的是( )
A.H2(g)+Cl2(g)=2HCl(g)△H=﹣184.6 kJ?mol﹣1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣802.3 kJ?mol﹣1
C.2H2(g)+O2(g)=2H2O(l)△H=﹣571.6 kJ?mol﹣1
D.CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283 kJ?mol﹣1
O2(g)=CO2(g)△H=﹣283 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
请回答:
(1)A的组成元素为(用化学符号表示),化学式为;
(2)C溶液可溶解铜片,例举该反应的一个实际应用;
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518gL﹣1),该气体分子的电子式为 , 写出该反应的离子方程式;
(4)写出F→G反应的化学方程式,设计实验方案探究溶液G中的主要微粒(不考虑H2O,H+ , K+ , I﹣) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)C(g)+D(g),当下列物理量不发生变化时:
①混合气体的密度
②容器内气体的压强
③混合气体的平均相对分子质量
④B的物质的量浓度
则能表明该反应一定已达到平衡状态的是( )
A.只有④
B.②③
C.②③④
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体NaOH配制0.1mol/L的NaOH溶液500mL,有以下仪器:
a.烧杯 b.1000mL容量瓶 c.500mL容量瓶 d.玻璃棒 e.托盘天平 f.100mL量筒
(1)配制时,必须使用的仪器有(填字母序号),还缺少的仪器是 .
(2)该实验两次用到玻璃棒,其作用分别是、 .
(3)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却.其正确的操作顺序是 .
(4)若使用密度为1.8g/mL、质量分数为98%的浓硫酸,配制1000mL0.18mol/L的稀硫酸,则需浓硫酸的体积是 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)=CO2(g)△H1;C(s)+ ![]() O2(g)=CO(g)△H2
O2(g)=CO(g)△H2
②S(s)+O2(g)=SO2(g)△H3;S(g)+O2(g)=SO2(g)△H4
③H2(g)+ ![]() O2(g)=H2O(l)△H5;2H2(g)+O2(g)=2H2O(l)△H6
O2(g)=H2O(l)△H5;2H2(g)+O2(g)=2H2O(l)△H6
④CaCO3(s)=CaO(s)+CO2(g)△H7;CaO(s)+H2O(l)=Ca(OH)2(s)△H8 .
A.②③④
B.④
C.①
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
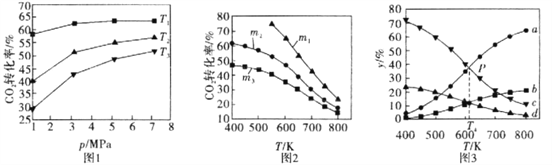
(1)图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=![]() 。
。
①图l中投料比相同,温度从高到低的顺序为________。
②图2中.m1、m2、m3投料比从大到小的顺序为________,理由是________。
(2)图3表示在总压为5MPa的恒压条件下,且m=3时,不同温度下各物质的物质的量分数与温度的关系。
①曲线b代表的物质为________(填化学式)。
②图3中P点时。CO2的转化率为________。
③T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com