
����Ŀ�������Ԫ�����ڱ���һ���֣��ش���������
���� | IA | ��A | ��A | ��A | ��A | ��A | ��A |
1 | |||||||
2 | �� | �� | �� | ||||
3 | �� | �� | �� | ||||
��1������Ԫ�آ�����⻯��ĵ���ʽΪ �� Ԫ�آۺ͢ݶ�Ӧ���⻯����ȶ�������д��ѧʽ����ͬ����Ԫ�آں͢�Ӧ����������ˮ�������Խ�ǿ���� ��
��2����ҵ�������ʢܵ�ԭ�������û�ѧ����ʽ��ʾ����
��3����֪ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ���Ԫ�آ���Ԫ�آܵ��������������Ƶ����ʣ�д��Ԫ�آٵ�����������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
��4��0.2mol�ĵ��ʢ���100mL2molL��1��FeBr2��Һ��Ӧ����������Fe2+��Br�������ʵ���֮���� ��
���𰸡�
��1��![]() ��H2O��HClO4
��H2O��HClO4
��2��2Al2O3 ![]() 4Al+3O2��
4Al+3O2��
��3��Be��OH��2+2NaOH=Na2BeO2+2H2O
��4��1��1
���������⣺��Ԫ�������ڱ��е�λ�ÿ�֪��ΪBe����ΪN����ΪO����ΪAl����ΪS����ΪCl����1����ΪN����Ӧ���⻯��Ϊ����������ʽΪ ![]() ��Ԫ�آۺ͢�λ��ͬһ���壬O�ķǽ����Խ�ǿ����Ӧ���⻯����ȶ����ǽ�����Cl��N����Ӧ����������ˮ�������Խ�ǿ���� HClO4 �� ���Դ��ǣ�
��Ԫ�آۺ͢�λ��ͬһ���壬O�ķǽ����Խ�ǿ����Ӧ���⻯����ȶ����ǽ�����Cl��N����Ӧ����������ˮ�������Խ�ǿ���� HClO4 �� ���Դ��ǣ� ![]() �� H2O�� HClO4����2�����ʢ�Ϊ������ҵ�õ��ķ���ұ��������ʽΪ2Al2O3
�� H2O�� HClO4����2�����ʢ�Ϊ������ҵ�õ��ķ���ұ��������ʽΪ2Al2O3 ![]() 4Al+3O2�������Դ��ǣ�2Al2O3
4Al+3O2�������Դ��ǣ�2Al2O3 ![]() 4Al+3O2������3��Ԫ��Be��Ԫ��Al���������������Ƶ����ʣ��������ڱ��Խ���λ�ã���֪��Al��OH��3+NaOH=NaAlO2+2H2O��Al��OH��3�������ԣ���Be��OH��2Ҳ�������ԣ�����NaOH��Һ��Ӧ�����κ�ˮ����Ӧ�Ļ�ѧ����ʽΪBe��OH��2+2NaOH�TNa2BeO2+2H2O��
4Al+3O2������3��Ԫ��Be��Ԫ��Al���������������Ƶ����ʣ��������ڱ��Խ���λ�ã���֪��Al��OH��3+NaOH=NaAlO2+2H2O��Al��OH��3�������ԣ���Be��OH��2Ҳ�������ԣ�����NaOH��Һ��Ӧ�����κ�ˮ����Ӧ�Ļ�ѧ����ʽΪBe��OH��2+2NaOH�TNa2BeO2+2H2O��
���Դ��ǣ�Be��OH��2+2NaOH=Na2BeO2+2H2O����4��Fe2+�Ļ�ԭ�Ա�Br��ǿ��ͨ��������������Fe2+ �� 0.2mol������������0.2molFe2+ �� 0.2molBr�� �� ���߱�ֵΪ1��1�����Դ��ǣ�1��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͬλ�ص�һ���ǣ�
A. ˮ����ˮB. Na2O��Na2O2C. 뭡�뮡��D. 40K��40Ca
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ����Cl2+2KBr=2KCl+Br2 �� ��KClO3+6HCl=3Cl2+KCl+3H2O����2KBrO3+Cl2=Br2+2KClO3 �� ����˵����ȷ���ǣ�������
A.����������Ӧ���е������ɣ����Զ����û���Ӧ
B.��������ǿ����˳��Ϊ KBrO3��KClO3��Cl2��Br2
C.��Ӧ���л�ԭ���������������ʵ���֮��Ϊ6��1
D.����lmol��ԭ����Ӧ���������õ����ӵ����ʵ���Ϊ2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С���������Ư���Ե�ʵ��̽��
��1����Ӧ��ͼ1��ʾ�ķ���ʵ�飬��������A����Ҫ�ɷ��������������ǿ�����ˮ�������ش��������⣺ 
�ٸ����о���ʵ�飩����ҪĿ���� ��
��Ũ����������� �� ���о�Ŀ��ֱ����ص�ʵ�������� ��
�۽�ʯ����Һ�ε�������ˮ�е����� ��
��2����Ϊ̽��SO2��Ư����SO2ֱ����������ɫ���ʣ�����SO2��ˮ��Ӧ�IJ���H2SO3�����ã������ͼ2װ�ý���ʵ�飺��ͼ2�������������������Ϊ70%�� ��Ϊ̽�������SO2 �ܲ���ʹƷ����ɫ����ָ����Ƶ�ʵ��װ��ͼ���������ԵIJ����е�һ��
�ڰ����ĺ��װ�ã�ʵ���п���SO2�Դ�Լÿ��3�����ݵ��ٶ�ͨ��Ʒ��ľƾ���Һʱ������һСʱ��Ʒ���Բ���ɫ����˵��Ʒ����ɫ��ԭ����SO2ֱ�ӵ��£����ԣ�SO2 ͨ��Ʒ��ˮ��Һ������Ʒ����ɫ�Ŀ����� �� ���ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС������ͼװ�ý���SO2��FeCl3��Һ�ķ�Ӧ 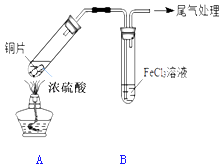
��1��д��װ��A�в���SO2�Ļ�ѧ����ʽ�� ��
��2����С��ͬѧ��ΪSO2��FeCl3��Һ�ܷ�����Ӧ�������� �� ��Ӧǰ��B����Һ����ɫ�仯Ϊ�� ��
��3�������������ʣ���Ԥ��FeCl3�����ܾ��е������ǣ��������ӷ���ʽ��ʾ����дһ�����ɣ� �� �����ʵ��֤�����Ԥ�⣨��ѡ���Լ���ʵ������������۽��б����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��X ����ۺ�����Ļ�ѧʽΪ HnXO2n-2������ij��̬�⻯���У�X Ԫ�صĻ��ϼ�Ϊ��
A. 5n-12B. 3n-12C. 3n-6D. n-10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������ͼ1װ����ȡ������������������ʵ�飮�ش��������⣺ 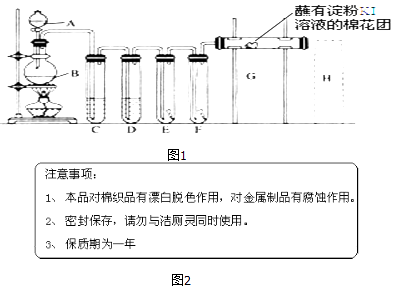
��1��A��ʢ��Ũ���ᣬB��ʢ��MnO2 �� д����Ӧ�Ļ�ѧ����ʽ ��
��2��D�з���ŨH2SO4 �� ��Ŀ���� ��
��3��E��Ϊ��ɫ�ɲ�����F��Ϊ��ɫʪ�������ɹ۲쵽�������ǣ� �� �Ա�E��F������IJ���ɵó��Ľ��ۼ������� ��
��4��G���������� ��
��5������H��β������װ��ͼ��ע���Լ� ��
��6����ͥ�г�������Һ����Ҫ�ɷ�NaClO�������飨��Ҫ�ɷ����ᣩ���������ijƷ������Һ��װ��˵����ͼ2�� �١�������ͬʱʹ�á�������ж���������д����Ӧ�����ӷ���ʽ�� ��
���衰�ܱձ��桱��ԭ����
�۷������Խ�����Ʒ�и�ʴ���á���ԭ���������
��7��������һ����Ϊ����ˮ�衱�IJ�ƷҲ�ܶ�����ˮ���п��ٵ�ɱ��������ҩ��ͨ�����������㣮�������Ⱦ� Cl2Na��NCO��3����ˮ��Ӧ�����ɴ�������ɱ���������ã������Ӻ��ڲ���������ƣ�Na2SO3���ܳ����ɽ�ˮ�е����ȣ�������ȣ���ȥ�� ���������ƽ�ˮ�ж���������ȥ�����ӷ�Ӧ����ʽΪ ��
������������Һ�ڿ������ױ��ʣ�������д����������������Һ�Ƿ���ʵ�ʵ��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������Mg��Zn��Al�����������ϡH2SO4��Ӧ������H2 2.8L����״������ԭ���������������ǣ�������
A.2g
B.4g
C.10g
D.12g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1mol/L�Ķ�Ԫ��H2A��Һ�У���Һ��ϵ���ܴ��ڵĺ�A���ӣ�H2A��HA����A2������ռ���ʵ���������pH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� �� 
A.H2A�ĵ��뷽��ʽΪ��H2AH++HA��
B.pH=5ʱ����NaHA��Na2A�Ļ����Һ�У�c��HA������c��A2����=1��100
C.�����ʵ���Ũ�ȵ�NaHA��Na2A��Һ�������ϣ�����Ũ�ȴ�С��ϵΪc��Na+����c��HA������c��A2����
D.Na2A��Һ�ش���c��OH����=c��H+��+c��HA����+2c��H2A����������Ũ�Ⱦ�����0
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com