
【题目】控制“酸雨”是防治大气污染的重要问题之一。煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用Ca(ClO)2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)Ca(ClO)2中氯元素的化合价为___________。
(2)工业上制备Ca(ClO)2的化学方程式_________________________________________________。
(3)实验室在鼓泡反应器中通入含有SO2的烟气,反应温度为323 K,Ca(ClO)2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42 | Cl |
c/(mol·L1) | 5×103 | 1×102 |
写出Ca(ClO)2溶液在脱硫过程中主要反应的离子方程式____________________________________。
(4)目前可用电化学方法处理由二氧化硫引起的酸雨。常见的一种方法是惰性电极电解氢溴酸,其阳极的电极反应为:___________________________________。阴极的电极反应为:_________________________________。总反应的化学方程式为:___________________________。
(5)将其阳极产物用水溶解配成溶液去淋洗含二氧化硫的废气。上述吸收废气发生的反应化学方程式为:________________________________________。若反应中转移电子1mol,则可吸收二氧化硫气体体积在标准状况下为_________L。
【答案】 +1价 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ClO-+H2O+SO2=SO42-+Cl-+2H+ 2Br--2e-=Br2 2H++2e-=H2↑ ![]() Br2+SO2+2H2O=2H2SO4+ 2HBr 11.2L
Br2+SO2+2H2O=2H2SO4+ 2HBr 11.2L
【解析】(1)Ca(ClO)2中氯元素的化合价为+1。
(2)工业上制备Ca(ClO)2的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(3)由表中数据可知,反应中二氧化硫被氧化为硫酸根、次氯酸根被还原为氯离子,因此,Ca(ClO)2溶液在脱硫过程中主要反应的离子方程式为ClO-+H2O+SO2=SO42-+Cl-+2H+。
(4)惰性电极电解氢溴酸,其阳极的电极反应为2Br--2e-=Br2,阴极的电极反应为2H++2e-=H2 ↑。总反应的化学方程式为: ![]() 。
。
(5)将其阳极产物用水溶解配成溶液去淋洗含二氧化硫的废气。上述吸收废气发生的反应化学方程式为Br2+SO2+2H2O=2H2SO4+ 2HBr。若反应中转移电子1mol,则可吸收二氧化硫气体的物质的量为0.5mol,在标准状况下为11.2L L。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】汽车内燃机工作时产生的电火花和高温会引起反应:N2(g)+O2(g)═2NO(g),导致汽车尾气中的NO和NO2对大气造成污染.
(1)在不同温度(T1 , T2)下,一定量的NO分解产生N2和O2的过程中N2的体积分数随时间t变化如图1所示.根据图像判断反应N2(g)+O2(g)═2NO(g)为反应(填“吸热”或“放热”),随着温度的升高,该反应的平衡常数K(填“增大”“减小”或“不变”,平衡向移动(填“向左”“向右”或“不”). 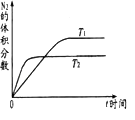
(2)某温度时,向容积为1L的密闭容器中充入5mol N2与2.5mol O2 , 发生N2(g)+O2(g)═2NO(g)反应,2min后达到平衡状态,NO的物质的量为1mol,则2min内氧气的平均反应速率为 , 该温度下,反应的平衡常数K= . 该温度下,若开始时向上述容器中加入的N2与O2均为1mol,则N2的平衡浓度为mol/L.
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.写出上述变化中的总化学反应方程式: . 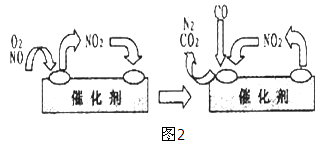
(4)用CH4催化还原NO2的方法也可以消除氮氧化物的污染.例如: CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ/mol
写出CH4还原NO2至N2的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应2C(g)A(g)+2B(g)△H<0,下列判断正确的是( )
A.任何温度下反应均难以自发进行
B.任何温度下反应均可以自发进行
C.仅常温下反应可以自发进行
D.仅高温下反应可以自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题.(题中的字母只代表元素代号,与实际元素符号无关):
(1)B的元素符号为_________,E元素在周期表中位于第____周期_____族;
(2)A、C、D三种元素组成的一种常见化合物,是氯碱工业的重要的产品,请写出该反应的化学方程式___________。
(3)A2C和A2E两种物质沸点较高的是_______(填写化学式),原因是:_______。
(4)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为____。B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示.下列说法不正确的是 ( ) 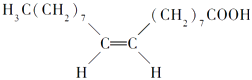
A.油酸的分子式为C18H34O2
B.油酸可与氢氧化钠溶液发生中和反应
C.1mol油酸可与2molH2发生加成反应
D.1mol甘油可与3mol油酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值。下列有关说法正确的是( )
A. 1mol乙酸、乙醇和甲酸甲酯的混合物中含有的碳原子数为2NA
B. 46gNa与一定量O2完全反应生成Na2O和Na2O2时转移的电子数为3NA
C. 0.5L1mol·L-1的NaHS溶液中含有的HS-、S2-的总数为0.5NA
D. 2molNO和1molO2充分反应后,体系中含有的NO2分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3②Na2CO3③KCl④CuCl2⑤NaHCO3可以得到相应盐的晶体(可以含有结晶水)的是( )
A.①③⑤
B.①②③
C.②④
D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
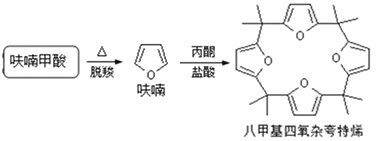
【题目】呋喃甲酸是抗菌素一种,在食品工业中作防腐剂,也作涂料添加剂、医药、香料等中间体,可用呋喃甲醛制备,其实验原理和制备步骤如下:
![]()
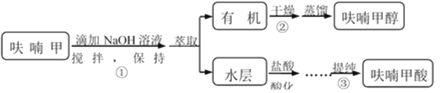
步骤③提纯过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥。
已知:①呋喃甲酸在100℃升华,133℃熔融,230-232℃沸腾,并在此温度下脱羧;
②呋喃沸点为31-32℃,易溶于水;
③无水氯化钙能与醇形成复合物。
(1)步骤①的关键是控制温度,其措施有:磁力搅拌、______和______。
(2)步骤②中干燥所使用的干燥剂可选用______。
A.98%浓硫酸 B.无水硫酸镁
C.无水碳酸钠 D.无水氯化钙
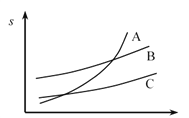
(3)呋喃甲酸在A、B、C三种溶剂中溶解度(s)随温度变化的曲线如图:步骤③提纯时,合适的溶解溶剂是______,其理由______。
(4)利用呋喃甲酸可以制取八甲基四氧杂夸特烯。
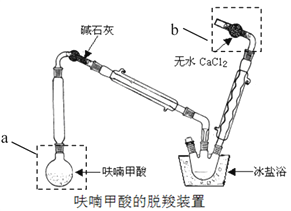
①仪器a的名称:______,装置b的作用:______,
②脱羧装置中用冰盐浴的目的是______;
③确定产品为八甲基四氧杂夸特烯,可通过测定沸点,还可采用的检测方法有______。
④若用4.5g呋喃甲酸制得了0.5g八甲基四氧杂夸特烯(M=432g·mol-1),则产率为______(保留4位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com