
下列有关说法正确的是
A.常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B.常温下,0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+)
C.常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中 的值增大到原来的10倍
的值增大到原来的10倍
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-)
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
汽车尾气净化中的一个反应如下:NO(g)+CO(g)=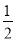 N2(g)+CO2(g) ΔH=-373.4KJ/mol
N2(g)+CO2(g) ΔH=-373.4KJ/mol
若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是
A.其它条件不变,加入催化剂,ΔH变大
B.及时除去二氧化碳,正反应速率加快
C.降低温度,可提高反应物的转化率
D.若气体的密度保持不变,说明平衡不发生移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省盟校高三第一次十校联考理综化学试卷(解析版) 题型:填空题
(15分)I.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g) 2ClNO(g) H1<0 其平衡常数为K1
2ClNO(g) H1<0 其平衡常数为K1
b、2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) H2<0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) H3的平衡常数K= (用K1、K2表示)。H3= (用H1、H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) H3的平衡常数K= (用K1、K2表示)。H3= (用H1、H2表示)。
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡。测得10min内υ(ClNO)=7.5×10-3molL-1min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2,α1 α2(填“>”“<”或“=”),平衡常数K1 (填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是 。
II.第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图:

其总反应式为H2+2NiOOH 2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省红色六校高三第二次联考理综化学试卷(解析版) 题型:选择题
 的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)
的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)
A.7种 B.6种 C.5种 D.4种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高三第三次四校联考理综化学试卷(解析版) 题型:填空题
(14分)锰锌铁氧体可制备隐形飞机上吸收雷达波的涂料。以废旧锌锰电池为原料制备锰锌铁氧体(MnxZn1-xFe2O4)的主要流程如下,请回答下列问题:

(1)酸浸时,二氧化锰被双氧水还原的化学方程式为 。
(2)活性铁粉除汞时,铁粉的作用是 (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4-在该pH范围内反应的主要产物。

①pH<6时反应的离子方程式为 。
②请根据该图给出pH对汞去除率影响的变化规律: 。
③试猜想在强酸性环境下汞的单位时间去除率高的原因: 。(不考虑KMnO4在酸性条件下氧化性增强的因素)
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成 。
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:实验题
B.草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC—COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:

步骤1:在上图所示装置中,加入无水草酸45g,无水乙醇81g,苯200mL,浓硫酸10mL,搅拌下加热6870℃回流共沸脱水。
步骤2:待水基本蒸完后,分离出乙醇和苯。
步骤3:所得混合液冷却后依次用水、饱和碳酸氢钠溶液洗涤,再用无水硫酸钠干燥。
步骤4:常压蒸馏,收集182-184℃的馏分,得草酸二乙酯57g。
(1)步骤1中发生反应的化学方程式是 ,反应过程中冷凝水应从 (填“a”或“b”)端进入。
(2)步骤2操作为 。
(3)步骤3用饱和碳酸氢钠溶液洗涤的目的是 。
(4)步骤4除抽气减压装置外所用玻璃仪器有蒸馏烧瓶、冷凝管、接液管、锥形瓶和 。
(5)本实验中,草酸二乙酯的产率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:选择题
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g) 2NH3(g) ΔH<0,相关数据如下表所示:
2NH3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时NH3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是
A.V甲>V丙 B.K乙>K丙 C.c乙>c甲 D.v甲=v丙
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省肇庆市高三一模化学试卷(解析版) 题型:填空题
(16分)
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H=+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H =-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图。假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。

(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应II生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
a.c ( H2 )减少;
b.平衡常数K增大;
c.CH3OH 的物质的量增加;
d.正反应速率加快,逆反应速率减慢;
e.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,

则:
Co2+在阳极的电极反应式为: ;
除去甲醇的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北枣强中学高一上学期期末考试化学试卷(解析版) 题型:选择题
下列溶液中通入SO2后,最终一定会出现沉淀的是
A.HCl和Ba(NO3)2的混合溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com