
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g) 2NH3(g) ΔH<0,相关数据如下表所示:
2NH3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时NH3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是
A.V甲>V丙 B.K乙>K丙 C.c乙>c甲 D.v甲=v丙
科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:填空题
[化学——物质结构与性质](13分)
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ.氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
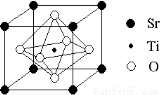
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。
Ⅱ.氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4 熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。

①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
C—S | C=S | C16S8中碳硫键 | |
键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省红色六校高三第二次联考理综化学试卷(解析版) 题型:填空题
(14分)(Ⅰ)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正 V逆(填“>”、“=”或“<”)。
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。

(3)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。
(Ⅱ)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.25mol·L-1 NaOH 溶液至20mL时,溶液由无色变为浅红色。第二份溶液滴加0.10 mol·L-1 酸性KMnO4溶液至16mL时反应完全。则原试样中H2C2O4·2H2O的的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高三第三次四校联考理综化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B.常温下,0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+)
C.常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中 的值增大到原来的10倍
的值增大到原来的10倍
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:填空题
(14分)质子交换膜燃料电池广受关注。
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+O2(g) CO(g) ΔH1=-110.35kJ·mol-1
CO(g) ΔH1=-110.35kJ·mol-1
2H2O(l) 2H2(g)+O2(g) ΔH2=+571.6kJ·mol-1
2H2(g)+O2(g) ΔH2=+571.6kJ·mol-1
H2O(l) H2O(g) ΔH3=+44.0kJ·mol-1
H2O(g) ΔH3=+44.0kJ·mol-1
则C(s)+H2O(g) CO(g)+H2(g) ΔH4= 。
CO(g)+H2(g) ΔH4= 。
(2)燃料气(流速为1800mL·h-1;体积分数为50% H2,0.98% CO,1.64% O2,47.38% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。
①160 ℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为 。
②灼烧草酸铈[ Ce2(C2O4)3]制得CeO2的化学方程式为 。
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示。

加入 (填酸的化学式)的CuO/CeO2催化剂催化性能最好。催化剂为CuO/CeO2—HIO3,120℃时,反应1h后CO的体积为 mL。
(3)图2为甲酸质子交换膜燃料电池的结构示意图。该装置中 (填“a”或“b”)为电池的负极,负极的电极反应式为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:选择题
下图装置可处理乙醛废水,乙醛在阴、阳极发生反应,分别转化为乙醇和乙酸。下列说法正确的是
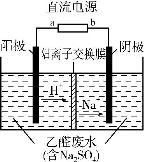
A.b电极为正极
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极电极反应式为CH3CHO-2e-+H2O CH3COOH+2H+
CH3COOH+2H+
D.电解过程中,两极均有少量气体产生,则阳极产生的是H2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:选择题
下列有关物质的性质和应用不正确的是
A.甲醛能使蛋白质变性,常用高浓度甲醛溶液浸泡食用海产品以防腐
B.硅胶多乳、吸水能力强,常用作袋装食品的干燥剂
C.过氧化钠能与二氧化碳反应产生氧气,可用作潜水艇的供氧剂
D.锌的金属活泼性比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三一模考试理综化学试卷(解析版) 题型:填空题
(16分)请你利用所学反应原理知识解决下列问题:
(1)若已知两个反应:①C(s)+2H2(g)=CH4(g) ΔH1= a kJ·mol-1 ;
②C(s)+ O2(g)=CO(g) ΔH2= b kJ·mol-1 ;
O2(g)=CO(g) ΔH2= b kJ·mol-1 ;
则2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH= (用含a、b的式子表示);
(2)碱性镁锰干电池是新开发的一种干电池,比普通锌锰干电池具有更加优越的性能,具有较大应用前景,其工作时总反应为:Mg+2MnO2+H2O=Mg(OH)2+Mn2O3;则工作时,正极发生 反应(填反应类型),写出负极的电极反应式: ;
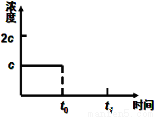
(3)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s) CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=;若某时刻达到平衡时c(CO2)= c;t0 时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在下图中画出t0以后此体系中CO2的浓度随时间变化的图像;
CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=;若某时刻达到平衡时c(CO2)= c;t0 时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在下图中画出t0以后此体系中CO2的浓度随时间变化的图像;
(4)某温度下数据:草酸(H2C2O4)的K1=5.4×10-2,K2=5.4×10-5;醋酸的K=1.75×10-5;碳酸的 K1=4.2×10-7,K2=4.5×10-11;Ksp(CaC2O4) =5.0×10-9;Ksp(CaCO3) =2.5×10-9
①用醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是 ;
②向0.6 mol/L的Na2CO3溶液中加入足量 CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32-(aq) + CaC2O4(s) CaCO3(s)+ C2O42-(aq),静置后沉淀转化达到平衡,求此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应,写出计算过程)。
CaCO3(s)+ C2O42-(aq),静置后沉淀转化达到平衡,求此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应,写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北枣强中学高一上学期期末考试化学试卷(解析版) 题型:选择题
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C、D两种元素对应气态氢化物的稳定性C>D;E是这五种元素中形成简单离子半径最小的元素。则它们的原子序数由小到大的顺序为
A.D<C<E<A<B B.A<B<C<D<E
C.E<B<A<C<D D.B<A<E<D<C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com